NOUS Pharm. 2010;35(5):36-41.
une relation entre le diabète sucré (DM) et la démence est indéniable, de nombreuses études concluant que le DM augmente le risque de déclin cognitif et de démence, y compris la maladie d’Alzheimer (ma).1-5 non seulement DM augmente le risque de démence, il augmente en fait le taux de développement de la démence de deux à trois fois.,3 le mécanisme de cette déficience n’est pas entièrement compris, mais on suppose que l’hyperglycémie, la résistance à l’insuline, le stress oxydatif, les produits finaux de glycation avancée et les cytokines inflammatoires conduisent collectivement à un dysfonctionnement cognitif.5 En fait, le diabète a été décrit comme un « type particulier de vieillissement accéléré”, en 1976, en raison de ses nombreuses complications associées.,5 le chevauchement apparent entre le DM et la démence a conduit à suggérer que la MA n’est pas seulement un trouble neurologique, mais plutôt un trouble neuroendocrinien, Steen et al inventant le terme diabète de type 3 pour décrire cette maladie hybride.,6
aperçu de la résistance à l’insuline/altération de la tolérance au Glucose
physiopathologie: une altération de la tolérance au glucose—définie comme une glycémie de 140 mg/dL à 199 mg/dL après un test de tolérance au glucose par voie orale—et une altération de la glycémie à jeun—définie comme une glycémie à jeun de 100 mg/dL à 125 mg / dL—sont diagnostiques du prédiabète (précurseur du DM de type 2 ), tout comme une hémoglobine A1C de 5,7% à 6,4%.7 la physiopathologie du prédiabète est la même que celle du T2DM, qui est diagnostiqué après une glycémie à jeun de 126 mg/dL ou plus ou un A1C de 6.,5% ou plus (test répété pour confirmation).7 dans les deux conditions, la résistance à l’insuline se développe dans les tissus périphériques, où l’insuline est nécessaire pour l’absorption du glucose (à savoir les muscles, le foie et les graisses), et le pancréas est obligé de fournir de plus en plus d’insuline pour surmonter cette résistance.8 à ce stade, les patients sont souvent hyperinsulinémiques; cependant, avec le temps, le pancréas ne peut pas répondre aux exigences des tissus et les cellules bêta productrices d’insuline du pancréas échouent lentement, produisant de plus en plus moins d’insuline.,8 sans insuline suffisante, les concentrations de glucose dans le sang augmentent, entraînant un prédiabète et, chez jusqu’à 70% des patients atteints de prédiabète, un T2DM.9 les complications de l’hyperglycémie sont nombreuses et comprennent un risque accru de complications macrovasculaires (y compris l’infarctus du myocarde, l’accident vasculaire cérébral et la maladie vasculaire périphérique) et de complications microvasculaires (y compris la néphropathie, la neuropathie et la rétinopathie).7
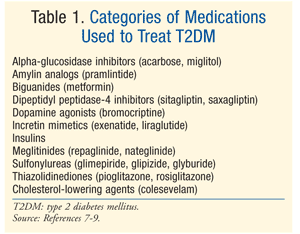
Traitement: de nombreuses thérapies existent pour traiter le DM., Le traitement initial pour le prédiabète et le T2DM est une modification du mode de vie impliquant un régime alimentaire, de l’exercice et une perte de poids.7 L’American Diabetes Association (ADA) recommande également la prise en compte de la metformine chez les patients atteints de prédiabète qui présentent un risque élevé de développer un diabète.7 la metformine est recommandée comme traitement pharmacologique initial pour T2DM.7 souvent, un traitement pharmacologique supplémentaire est nécessaire pour atteindre les objectifs glycémiques ADA, y compris un A1C <7%.,7 Il existe de nombreuses classes de médicaments pour le T2DM (tableau 1), et le choix de l’agent pour normaliser la glycémie dépend d’une foule de facteurs spécifiques au patient et au médicament. Il est important de noter que de nombreux patients atteints de T2DM auront éventuellement besoin d’insuline exogène pour atteindre et maintenir l’euglycémie à mesure que la fonction des cellules bêta diminuera progressivement.
aperçu de la MA
physiopathologie: la MA est la forme de démence la plus courante chez les personnes âgées, représentant 60% à 80% de tous les cas.,10 deux caractéristiques histopathologiques de la MA sont les plaques neuritiques et les enchevêtrements neurofibrillaires.11 Plaques sont constituées de protéines bêta-amyloïdes insolubles. Les enchevêtrements, intracellulaires, sont composés de protéines tau phosphorylées. La protéine Tau est importante pour l’assemblage des microtubules, et lorsque cette protéine est anormalement phosphorylée, la fonction neuronale est interrompue. Les enchevêtrements neurofibrillaires affectent le plus souvent les neurones cholinergiques.12 en outre, la perturbation du principal neurotransmetteur excitateur, le glutamate, contribue à la pathologie de la MA., Dans la MA, il y a une suractivation du glutamate, signalant un processus connu sous le nom d’excitotoxicité, qui conduit à la formation de plaque, à l’hyperphosphorylation de la protéine tau et à la mort cellulaire.12 En résumé, l’excitotoxicité et la formation de plaques neuritiques et d’enchevêtrements neurofibrillaires perturbent les voies des neurotransmetteurs, entraînant des troubles de l’apprentissage et de la mémoire associés à la MA.
traitement: les traitements pharmacologiques disponibles approuvés par la FDA pour la MA sont résumés dans le tableau 2.,11,12 bien qu’il reste encore beaucoup à apprendre en ce qui concerne les thérapies qui traitent ou modifient la pathologie de la MA, les thérapies actuellement disponibles impliquent l’utilisation d’inhibiteurs de l’acétylcholinestérase, dont il existe quatre, et de la mémantine, antagoniste des récepteurs N-méthyl-D-aspartate.

l’Insuline et le Cerveau
Bien qu’il est nécessaire pour le transport du glucose dans les tissus périphériques à l’insuline ne semble pas être nécessaire pour le transport de glucose dans le cerveau ou pour le métabolisme du glucose cérébral., Alors que le transport du glucose vers le cerveau ne dépend pas de l’insuline, l’insuline elle–même est transportée à travers la barrière hémato–encéphalique (BBB) par des processus de transport médiés par les récepteurs de l’insuline.13 ce mécanisme de transport est saturable; lors de périodes prolongées de concentrations excessives d’insuline (hyperinsulinémie) en périphérie, telles que celles observées dans le prédiabète et le T2DM, ce mécanisme de transport médié par les récepteurs régule à la baisse, réduisant ainsi le transport de l’insuline dans le cerveau et le liquide céphalo-rachidien.,
en plus de l’insuline, le facteur de croissance analogue à l’insuline de type 1 (IGF-1) est présent dans le cerveau et est nécessaire à la croissance et au fonctionnement normaux du système nerveux central (SNC).14 Les récepteurs de L’insuline et de L’IGF-1 sont situés dans tout le cerveau sur les neurones et les astrocytes (cellules en forme d’étoile dans le SNC qui aident à soutenir les neurones dans le cerveau). Deux zones du cerveau qui sont essentielles pour l’apprentissage et la mémoire, l’hippocampe et l’hypothalamus, qui contiennent des concentrations élevées de récepteurs d’insuline.5 chez le rat, il a été démontré que l’administration intracérébroventriculaire d’insuline améliore la mémoire.,15 en outre, l’administration intranasale d’insuline chez l’homme s’est avérée augmenter les performances de la mémoire.16 comme indiqué précédemment, l’insuline n’est pas nécessaire pour le métabolisme cérébral du glucose; cependant, il peut y avoir des zones spécifiques du cerveau dans lesquelles l’insuline déclenche des processus métaboliques impliquant le glucose. Dans les études de rat, l’insuline a été montré pour influencer l’utilisation du glucose dans l’hypothalamus et le locus coeruleus, deux domaines qui sont importants pour l’apprentissage et la mémoire.,17 Il a également été démontré que L’apprentissage facilite l’expression accrue des récepteurs de l’insuline du SNC, ce qui conduit à l’hypothèse que la présence et l’activité de l’insuline dans le cerveau contribuent et jouent un rôle essentiel dans l’apprentissage et la mémoire. L’insuline peut également contribuer à la modulation des neurotransmetteurs du SNC, notamment l’acétylcholine et la noradrénaline, qui sont tous deux essentiels pour la cognition normale et la santé du cerveau.,18
résistance à l’insuline et démence
aperçu: il semble y avoir de nombreux défauts dans la signalisation de l’insuline dans le cerveau des patients atteints de ma, entraînant une diminution de l’utilisation du glucose et du métabolisme énergétique.6,19 comme la T2DM est associée à une résistance périphérique à l’insuline, la MA est associée à une résistance cérébrale à l’insuline.20 Au début de la MA, il semble y avoir une absorption et une signalisation inadéquates de l’insuline dans le cerveau, un signe de résistance à l’insuline.5,19,21,22 une augmentation des récepteurs de l’insuline a été observée dans le cerveau des patients atteints de ma, probablement en compensation de la résistance à l’insuline.,21
dans l’ensemble, cette altération de la signalisation de l’insuline a de nombreux effets en aval dans la MA. Une théorie est que de faibles concentrations d’insuline dans le SNC provoquent une diminution des niveaux d’acétylcholine et du flux sanguin cérébral.13 de plus, des altérations des concentrations d’insuline peuvent favoriser la formation de bêta-amyloïdes et de protéines tau.2 dans le cerveau, l’enzyme dégradant l’insuline (e) est impliquée dans la dégradation et la clairance des protéines bêta-amyloïdes.21 des niveaux élevés d’insuline inhibent L’E et peuvent entraîner une diminution de la clairance bêta-amyloïde, augmentant par la suite le dépôt cérébral de bêta-amyloïde.,5,19,21
récemment, les céramides, une famille de lipides, ont retenu l’attention pour leur rôle potentiel dans la résistance à l’insuline et la démence.23,24 céramides sont générés en présence d’inflammation, ce qui est fréquent dans l’obésité, T2DM, et AD.24 comme le céramide croise facilement le BBB, l’exposition entraîne une altération du métabolisme énergétique et des altérations de l’expression des gènes de l’insuline, contribuant à la résistance à l’insuline.23,24 il s’agit actuellement d’un domaine d’intérêt actif, les chercheurs démontrant que l’inhibition de la synthèse du céramide empêchait la résistance à l’insuline induite par l’obésité.,24
insuline intranasale: comme mentionné précédemment, l’administration d’insuline intranasale améliore les performances de la mémoire chez l’homme.16 Plusieurs études sur l’insuline intranasale ont été menées. Lors de l’administration de 20 unités d’insuline intranasale deux fois par jour à des sujets humains, Reger et al ont constaté que, par rapport au placebo, le groupe traité avec de l’insuline conservait plus d’informations verbales et montrait une amélioration de l’attention et de l’état fonctionnel.,25 ces chercheurs ont également noté que le glucose et l’insuline plasmatiques à jeun ne changeaient pas avec l’utilisation d’insuline intranasale, ce qui indique que l’administration intranasale fournit un accès direct à l’insuline au SNC sans effets périphériques.25,26
agonistes PPAR-Gamma: largement étudiés pour le traitement de la résistance périphérique à l’insuline, les thiazolidinediones rosiglitazone et pioglitazone sont à l’étude pour leur rôle dans le traitement de la MA. Les Thiazolidinediones sont des agonistes gamma des récepteurs activés par les proliférateurs de peroxysomes (PPAR)., PPAR-gamma est impliqué dans le métabolisme du glucose et des lipides et module l’inflammation, un contributeur connu à la MA.22,27 les Thiazolidinediones sont des sensibilisants à l’insuline, agissant pour réduire la résistance à l’insuline; ils semblent également diminuer l’inflammation.21,26 dans plusieurs essais contrôlés versus placebo, les patients traités par rosiglitazone ont montré une amélioration de la mémoire et de la fonction cognitive.21,22,28 bien que seules de petites études sur la pioglitazone aient été menées, ce médicament a également été associé à des améliorations de la mémoire et de la cognition.,22 bien que la pioglitazone et la rosiglitazone aient une faible perméabilité au BBB, chacun de ces agents a été documenté dans le cerveau après administration orale.22 bien que ces médicaments puissent jouer un rôle dans la prévention ou le traitement de la MA, ils ne sont pas actuellement approuvés par la FDA pour les patients atteints de ma, et leurs avantages et risques potentiels doivent être soigneusement pris en compte sur une base individuelle.
exercice aérobique: l’activité physique est peut-être la méthode la plus efficace et la plus négligée pour réduire la résistance à l’insuline., L’obésité a été associée à un risque accru de résistance à l’insuline, de diabète, de démence et de ma.29,30 L’exercice améliore la sensibilité à l’insuline et abaisse les niveaux d’insuline périphériques.26,31 l’activité physique, indépendante du poids, est associée à un risque moindre de ma, ce qui en fait la seule thérapie neuroprotectrice éprouvée.29-31 un mécanisme possible de cette neuroprotection est que l’exercice favorise la clairance des protéines bêta-amyloïdes et augmente le facteur neurotrophique dérivé du cerveau, un facteur de croissance vital pour la cognition et la survie neuronale qui est réduit dans la MA.,32
rôle du pharmacien
Les pharmaciens jouent un rôle essentiel dans l’éducation des patients sur les nouveaux traitements; ils doivent également se tenir au courant des nouvelles découvertes médicales ou des conditions qui sont fréquemment présentées dans les nouvelles. Le diabète de Type 3 est l’une de ces affections. Bien qu’il reste beaucoup à apprendre sur ce nouveau lien potentiel entre le diabète et la cognition altérée, le public demandera l’opinion de leurs fournisseurs de soins de santé. En outre, de nombreux patients atteints de diabète seront intéressés à en apprendre davantage et se tourneront vers leurs pharmaciens pour obtenir des informations., Par conséquent, les pharmaciens devraient discuter de la compréhension actuelle de cette condition avec leurs patients et également les conseiller sur les stratégies qui peuvent diminuer leur risque, compte tenu de leurs comorbidités individuelles.
Conclusion
Une étude Intensive est en cours pour tenter de mieux caractériser le diabète de type 3 et de développer des stratégies préventives et thérapeutiques. À ce jour, il n’existe aucun traitement spécifique ayant une efficacité prouvée dans la prévention du déclin cognitif ou de la ma chez les patients atteints de DM., Par conséquent, la prise en charge des troubles cognitifs chez les patients atteints de DM est identique à celle des patients sans DM, avec une attention particulière au contrôle glycémique et aux facteurs de risque cardiovasculaires. Il s’agit de la même approche déjà essentielle pour prévenir les complications liées au DM. Bien que certains groupes de patients semblent présenter un risque accru de déficience cognitive, la majorité des patients atteints de DM n’ont pas d’associations cliniques bien définies., Bien qu’aucune option de traitement spécifique ne soit disponible, l’approche logique actuelle est d’atteindre le contrôle glycémique et de gérer prudemment les facteurs de risque cardiovasculaires, tels que l’hyperlipidémie et l’hypertension.
1. Stewart R, Liolitsa D. diabète sucré de Type 2, déficience cognitive et démence. Diabet Med.
2. Xu WL, von Strauss E, Qiu CX, et coll. Le diabète non contrôlé augmente le risque de maladie d’Alzheimer: une étude de cohorte. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabète sucré, démence et fonction cognitive chez les personnes âgées., J Nutr Santé Vieillissement. 2006;10:287-291.
4. Jacobson AM, Musen G, Ryan CM, et coll. Effet à Long terme du diabète et de son traitement sur la fonction cognitive. N Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. Diabète de Type 2 et risque de déficience cognitive et de démence. Curr Neurol Neurosci La République De 2007;7:373-380.
6. Steen E, Terry BM, Rivera EJ, et coll. Altération de l’expression et des mécanismes de signalisation de l’insuline et du facteur de croissance analogue à l’insuline dans la maladie d’Alzheimer—est-ce un diabète de type 3? J Alzheimers Dis. 2005;7:63-80.
7. Association Américaine Du Diabète. Normes de soins médicaux dans le diabète 2010., Les Soins Du Diabète.
8. Triplitt Cl, REASNER CA, Isley WL. Le diabète sucré. Dans: DiPiro JT, Talbert RL, Yee GC,et al, éd. Principes de pharmacothérapie& pratique. 7ème ed. New York, New York: McGraw Hill Médical; 2008:1205-1241.
9. Nathan DM, Buse JB, Davidson MD, et coll. La gestion médicale de l’hyperglycémie dans le diabète de type 2: un consensus algorithme pour l’initiation et l’ajustement de la thérapie: une déclaration de consensus de l’American Diabetes Association et l’Association Européenne pour l’Étude du Diabète. Les Soins Du Diabète.
10. Hebert LE, Scherr PA, Bienias JL, et al., Maladie d’Alzheimer dans la population américaine: estimations de la prévalence à l’aide du Recensement de 2000. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. la maladie d’Alzheimer. N Engl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill AM. La maladie d’Alzheimer. Dans: DiPiro JT, Talbert RL, Yee GC,et al, éd. Principes de pharmacothérapie& pratique. 7ème ed. New York, New York: McGraw Hill Médical; 2008:1051-1065.
13. Craft S, Watson GS. Insuline et maladie neurodégénérative: mécanismes communs et spécifiques. Lancet Neurol. 2004;3:169-178.
14. de la Monte SM, baguettes JR., L’examen de l’insuline et l’insuline-like growth factor expression, de signalisation, et un dysfonctionnement dans le système nerveux central: la pertinence de la maladie d’Alzheimer. J Alzheimers Dis. 2005;7:45-61.
15. Parc CR, Seeley RJ, Artisanat S, Bois SC. L’insuline intracérébroventriculaire améliore la mémoire dans une tâche d’évitement passif. Physiol Behav. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et coll. Manipuler les voies neuropeptidergiques chez l’homme: une nouvelle approche de la neuropharmacologie? Eur J Pharmacol. 2000;405:43-54.
17. Zhao WQ, Alkon DL. Rôle de l’insuline et du récepteur de l’insuline dans l’apprentissage et la mémoire., Mol Cell Endocrinol. 2001;177:125-134.
18. Kopf S, Baratti C. effets de l’administration post-entraînement de l’insuline sur la rétention d’une réponse d’accoutumance chez la souris: participation d’un mécanisme cholinergique central. Neurobiol Apprendre Mem.
19. Revill P, Moral MA, Prous JR. signalisation de L’insuline altérée et la pathogenèse de la maladie d’Alzheimer. Drogues Aujourd’Hui (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Longato L, et coll. Neurodégénérescence limitée de type Alzheimer dans l’obésité expérimentale et le diabète sucré de type 2. J Alzheimers Dis. 2008;15:29-44.
21. Haan MN., Aperçu de la thérapie: diabète sucré de type 2 et risque de maladie D’Alzheimer tardive. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar S, et coll. Ppargamma agonists comme thérapeutique pour le traitement de la maladie D’Alzheimer. Neurotherapeutics. 2008;5:481-489.
23. Il s’agit d’un groupe de travail composé de membres du personnel, de membres du Personnel, de membres du personnel et de membres du personnel. Le céramide hépatique peut être le médiateur de la résistance à l’insuline et de la neurodégénérescence cérébrales dans le diabète de type 2 et la stéatohépatite non alcoolique. J Alzheimers Dis.
le 24. Tong M, de La Monte SM. Mécanismes de neurodégénérescence médiée par le céramide. J Alzheimers Dis.
25., Reger MA, Watson GS, Vert PS. L’insuline intranasale améliore la cognition et module la bêta-amyloïde au début de la MA. Neurologie. 2008;70:440-448.
26. Craft S. syndrome de résistance à l’insuline et maladie D’Alzheimer: effets liés à l’âge et à l’obésité sur la mémoire, l’amyloïde et l’inflammation. Neurobiol Vieillissement. 2005; 26 (suppl 1): 65-69.
27. Jiang Q, Heneka M, Landreth GE. Le rôle de peroxisome proliferator-activated receptor gamma (PPARgamma) dans la maladie d’Alzheimer: implications thérapeutiques. Médicaments CNS. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, et coll., Cognition préservée chez les patients présentant une maladie D’Alzheimer précoce et une déficience cognitive légère amnésique pendant le traitement par rosiglitazone: une étude préliminaire. Am J Gériatr Psychiatrie. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. adiposité et la maladie d’Alzheimer. Curr La Maladie D’Alzheimer Rés. 2007;4:127-134.
30. Whitmer RA. L’épidémiologie de l’adiposité et de la démence. Curr La Maladie D’Alzheimer Rés. 2007;4:117-122.
le 31. Watson GS, Craft S. le rôle de la résistance à l’insuline dans la pathogenèse de la maladie d’Alzheimer: implications pour le traitement. Médicaments CNS. 2003;17:27-45.
32. Cole GM, Frautschy SA., Le rôle de l’insuline et le facteur neurotrophique de signalisation dans le cerveau, le vieillissement et la maladie d’Alzheimer. Exp Gerontol. 2007;42:10-21.
















Laisser un commentaire