| University of Sheffield | |
| Oddělení Chemie | VSEPR |
Amoniak má také čtyři elektronové páry a koordinační geometrie dusíku je založen na tetraedrické uspořádání elektronové páry. Existují jen tři lepené skupiny, proto existuje jeden osamělý pár. Vzhledem k tomu, že osamělé páry jsou „neviditelné“, tvar amoniaku je pyramidální.,r>
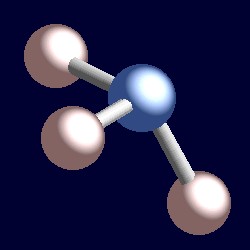
zvažte vazebný pár elektronů. Oba elektrony jsou umístěny mezi dvěma jádry a jsou přitahovány oběma. Osamělý pár je jiný. Je nutně přitahován pouze k jednomu jádru a důsledkem je, že zaujímá pozici účinně blíže k tomuto jádru než vazebné páry elektronů. To znamená, že efektivní pevný úhel obsazený osamělým párem je větší než úhel obsazený dvojicí vazeb., Osamělé páry vyžadují větší úhlovou místnost a jsou umístěny blíže k jejich atomům než páry vazeb. Důsledkem tohoto pro amoniak je, že osamělý pár dělá prostor pro sebe tím, že tlačí tři atomy vodíku spolu málo a H-N-H bond úhly jsou o něco méně (106.6°), než je ideální tetraedrický úhel 109.5°.
















Napsat komentář