při zvýšení teploty se zvyšuje rychlost enzymových reakcí. Deset stupňů Celsia zvýšení teploty zvýší aktivitu většiny enzymů o 50% na 100%. Změny reakční teploty tak malé jako 1 nebo 2 stupně mohou ve výsledcích způsobit změny o 10% až 20%. Toto zvýšení je pouze do určitého bodu, dokud zvýšená teplota nerozbije strukturu enzymu. Jakmile je enzym denaturován, nelze jej opravit., Vzhledem k tomu, že každý enzym má jinou strukturu a vazby mezi aminokyselinami a peptidy, je teplota denaturace specifická pro každý enzym. Protože většina živočišných enzymů se při teplotách nad 40°C rychle denaturuje, většina stanovení enzymů se provádí poněkud pod touto teplotou.
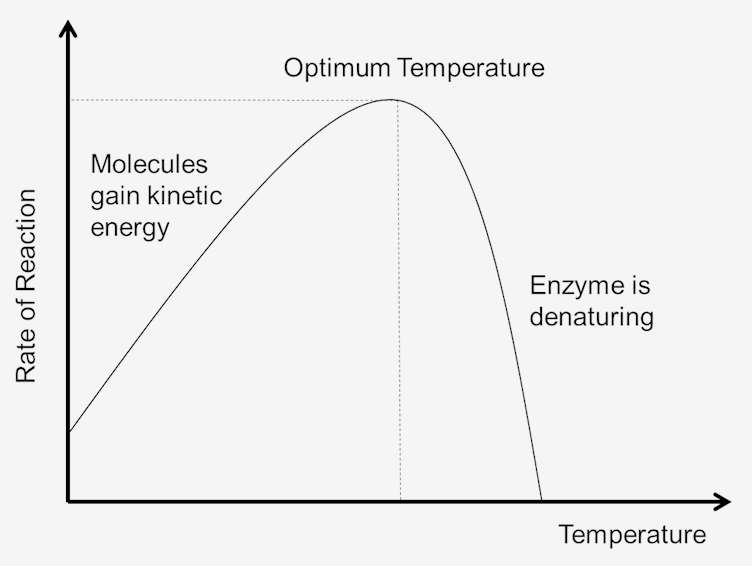 Obrázek 1. Vliv teploty na reakční rychlost.
Obrázek 1. Vliv teploty na reakční rychlost.
po určitou dobu budou enzymy deaktivovány i při mírných teplotách. Skladování enzymů při teplotě 5 ° C nebo nižší je obecně nejvhodnější. Nižší teploty vedou k pomalejším chemickým reakcím., Enzymy se nakonec stanou neaktivními při teplotách pod bodem mrazu, ale obnoví většinu své enzymové aktivity, když se teploty opět zvýší, zatímco některé enzymy ztratí svou aktivitu při zmrazení.
Kinetická Energie a Vnitřní Energie
teplota systému je do jisté míry měřítkem kinetické energie molekul v systému. Kolize mezi všemi molekulami se zvyšují s nárůstem teploty. To je způsobeno zvýšením rychlosti a kinetické energie, která následuje po zvýšení teploty. Při rychlejších rychlostech bude mezi kolizemi méně času., To má za následek, že více molekul dosáhne aktivační energie, což zvyšuje rychlost reakcí. Vzhledem k tomu, že molekuly se také pohybují rychleji, také se zvyšují srážky mezi enzymy a substráty. Čím nižší je kinetická energie, tím nižší je teplota systému a podobně, tím vyšší je kinetická energie, tím větší je teplota systému.
jak se zvyšuje teplota systému, zvýší se vnitřní energie molekul v systému., Vnitřní energie molekuly mohou obsahovat translační energie, vibrační energie a rotační energie molekul, energie v chemických vazeb molekul, stejně jako energie v nonbonding interakce. Část tohoto tepla může být přeměněna na energii chemického potenciálu. Pokud je toto zvýšení chemické potenciální energie dostatečně velké, některé slabé vazby, které určují trojrozměrný tvar aktivních proteinů, mohou být přerušeny. To by mohlo vést k tepelné denaturaci proteinu a inaktivovat protein., Tak příliš mnoho tepla může způsobit rychlost enzymu katalyzované reakce ke snížení, protože enzym nebo substrát se stává denaturované a neaktivní.
optimální teplota
každý enzym má teplotní rozsah, ve kterém je dosaženo maximální rychlosti reakce. Toto maximum je známé jako teplotní optimum enzymu. Optimální teplota pro většinu enzymů je asi 98,6 stupňů Fahrenheita (37 stupňů Celsia). Existují také enzymy, které dobře fungují při nižších a vyšších teplotách., Například arktická zvířata mají enzymy přizpůsobené nižším optimálním teplotám; zvířata v pouštním podnebí mají enzymy přizpůsobené vyšším teplotám. Enzymy jsou však stále proteiny a stejně jako všechny proteiny se začínají rozkládat při teplotách nad 104 stupňů Fahrenheita. Proto je rozsah enzymové aktivity určen teplotou, při které se enzym začíná aktivovat, a teplotou, při které se protein začíná rozkládat.,
Související Služby,
Enzymové Kinetiky
Enzymologie Testy
diskutovat o další služby, podrobnosti, prosím, kontaktujte nás na telefonním čísle 1-631-562-8517, nebo e-mailem na [email protected].
















Napsat komentář