Úvod
Replikace v jádře eukaryotických buněk zaměstnává tři DNA polymerázy: polymerázy α, δ a ε (Hubscher et al., 2002; Pavlov et al., 2006b; Kunkel and Burgers, 2008; Loeb and Monnat, 2008; Burgers, 2009; Pavlov and Shcherbakova, 2010; Lange et al., 2011)., Syntéza DNA je směrové a probíhá od 5′ k 3′, kde nucleophilic útok na α fosfát z nukleotidů na 3 ‚ OH primeru výsledky v začlenění skupinou monofosfát a uvolnění pyrofosforečnan (Steitz, 1999). Všechny DNA polymerázy vyžadují základní nátěr a volnou 3 ‚ OH k provedení syntézy DNA a pol α není výjimkou. Pol α je heterotetramer složený ze dvou podjednotek primázy a dvou podjednotek polymerázy., Podjednotky primázy iniciují replikaci DNA syntetizací krátkých (7-12 ribonukleotidů) RNA primerů, které jsou pak rozšířeny polymerázou α (Pellegrini, 2012). DNA polymeráza δ a ε protáhnou primery generované pol α přesným a procesivním způsobem (Kunkel, 2004, 2011; Pellegrini, 2012). V droždí, DNA polymeráza δ bylo prokázáno, že být důležité pro syntézu DNA z zaostávající strand vzhledem k tomu, že pol ε zdá především funkce na přední pramen (Pursell et al., 2007; Nick Mcelhinny et al., 2008; Kunkel, 2011; Georgescu et al., 2014)., Naproti tomu v mitochondriích je replikace odpovědností jedné jediné polymerázy, DNA polymerázy γ (Lee et al., 2009).
DNA polymerázy jsou seskupeny do sedmi rodin (A, B, C, D, X, Y a RT). V eukaryotes tři jaderné replikativní DNA polymerázy náhodou patří do rodiny B (hamburgery et al., 2001; Patel a Loeb, 2001). Nyní jsou krystaly struktury všech tří replikativní DNA polymerázy z kvasinek, které umožňují poprvé porovnání jejich společných konstrukčních prvků, stejně jako studie o jejich jedinečné vlastnosti (Swan et al., 2009; Perera et al.,, 2013; Hogg et al., 2014; Jain et al., 2014a). Všechny tři replikativní DNA polymerázy jsou multi-podjednotky enzymů (Tabulka 1) (Johansson a Macneill, 2010; Pavlov a Shcherbakova, 2010; Makarova et al., 2014). Hlavní zaměření této recenze je na jejich katalytickou doménu nebo podjednotku a.
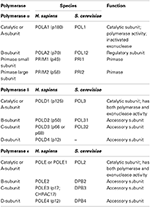
Tabulka 1. Eukaryotické DNA polymerázy jsou multi-podjednotkové enzymy.,
Celková Struktura B Rodina Polymerázy
Všechny DNA polymerázy sdílejí společný polymerázové složit, který byl ve srovnání s lidským pravé ruky, který se skládá ze tří subdomén: prsty, dlaň a palec (Steitz, 1999; Patel a Loeb, 2001). Palm, vysoce konzervovaným složit skládá ze čtyř antiparalelních β řetězců a dvou spirál, přístavy dva striktně konzervované katalytické aspartates nachází v motiv, DXXLYPS a motiv C, DTD (Delarue et al., 1990; Braithwaite a Ito, 1993)., Tento ROZUMÍTE-jako fold je sdílen velkou skupinou enzymů, včetně DNA a RNA polymerázy, reverzní transcriptases, CRISPR polymerázy, a dokonce zvrátit (3′-5′) transferázy jako Thg1 (Anantharaman et al., 2010; Hyde et al., 2010). Naproti tomu subdomény palce a prstů vykazují podstatně větší strukturální rozmanitost (Steitz, 1999). Prsty procházejí konformační změnou po vazbě DNA a správném příchozím nukleotidu. Tento pohyb umožňuje, aby zbytky v subdoméně prstů přicházely do styku s nukleotidem v rodícím se základním páru., Palec drží duplex DNA během replikace a hraje roli v procesivitě (Doublié a Ellenberger, 1998; Doublié et al., 1999).
Eukaryotické DNA polymerázy α, δ a ε sdílet homologie s mnoha archaeal, bakteriální, bakterie a virové polymerázy (Delarue et al., 1990; Braithwaite a Ito, 1993; Franklin et al., 2001; Firbank et al., 2008; Wang a Yang, 2009)., Koonin a spolupracovníci přispěli detailní fylogenetická analýza archaeal DNA polymerázy a jejich vztah s eukaryotické polymerázy v této otázce Hranic, v Mikrobiologii věnována polymerázy Makarova et al. (2014).
B rodina polymerázy jsou složeny z pěti subdomén: prsty, palec a dlaň (popsáno výše), které tvoří jádro enzymu, stejně jako exonuclease domény a N-terminální doména (NTD) (Franklin et al., 2001; Xia a Konigsberg, 2014) (Obrázek 1; tabulka S1)., Exonukleázová doména nese aktivitu korektury 3 ‚-5‘, která odstraňuje chybně zaznamenané nukleotidy. Aktivní místo exonukleázy se nachází 40-45 Å od aktivního místa polymerázy. Zdá se, že NTD postrádá katalytickou aktivitu. V pol δ NTD obsahuje tři motivy: jeden má topologie připomínající OB složit, single-stranded DNA binding motif, a další medvědi RNA-binding motif (RNA Recognition Motif nebo ROZUMÍTE) (Swan et al., 2009). V bakteriofágu T4 mutace v NTD snižují expresi polymerázy (Hughes et al., 1987)., V RB69 a T4 polymeráza gp43 váže svou vlastní messenger RNA, pravděpodobně prostřednictvím NTD a potlačuje překlad (Petrov et al., 2002), což se nezdá být případ pol δ (Swan et al., 2009). Nová data ukazují, že NTD hraje roli v stabilitě a věrnosti polymerázy prostřednictvím interakcí s jinými doménami (Li et al., 2010; Prindle et al., 2013) (viz níže).
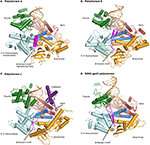
Obrázek 1. Ternární komplexy polymeráz α, δ, ε a RB69 gp43 jsou ilustrovány z identických orientací pro srovnání., Palec (zelená) a prsty (Tmavě modrá) domény uchopit duplexní nukleové kyseliny (primer je znázorněno v béžové, šablona v oranžové barvě) proti palmového domény (červená). N-terminální doména se objevuje ve zlatě, sousedící s 3 ‚ -5 ‚ exonukleázovou doménou (azurovou). (A) polymeráza α (PDBID 4FYD) váže RNA/DNA hybrid, kde je v blízkosti palce viditelná široká, mělká malá drážka DNA ve formě a. Exonukleázová doména 3 ‚ -5 postrádá aktivitu. Spirálovitá oblast (purpurová) v inaktivované doméně exonukleázy stabilizuje 5 ‚ end šablony., (B) Polymerázy δ (PDBID 3IAY) skrývá velký β-vlásenka motiv (magenta), což je důležité při přepínání primer strand od polymeráza aktivní místo na exonuclease aktivní stránky v případě korektury. (C) polymeráza ε (PDBID 4M8O) má jedinečnou P-doménu (fialovou), která poskytuje polymerázu se zvýšenou procesivitou. Zajímavé je, že motiv β vlásenky je v polštině atrofován., (D) Zachování rodiny B DNA polymeráza složit, a domény organizace, je evidentní, když model enzymu z bakteriofága RB69 gp43 (PDBID 2OZS) je viděn spolu s třemi eukaryotní replikační polymerázy. Vymezení domény pro každou polymerázu je uvedeno v tabulce s1. Obrázek byl vyroben s PyMOL (molekulární grafický systém PyMOL, verze 1.5.0.4 Schrödinger, LLC.).
Všechny savčí B rodině DNA polymerázy jsou známé harbor dva cystein-rich metal vazebná místa (CysA a CysB) v jejich C-terminální domény (CTD) (Obrázek 2)., Předpokládá se, že cysa je místem vázajícím zinek, zatímco CysB je klastr síry železa (Netz et al., 2012). Ztráta klastru v CTD kvasinek pol δ negativně ovlivňuje interakce s jeho příslušenstvím B-podjednotka (Sanchez Garcia et al., 2004). Zinek-vázající motiv bylo prokázáno, že být důležité pro interakci pol δ s jeho processivity faktor PCNA (Netz et al., 2012).

Obrázek 2. Schematický diagram tří Saccharomyces cerevisiae replikativní DNA polymeráz α, δ a ε., Pro srovnání je ukázána DNA polymeráza z bakteriofágu RB69.
DNA Polymeráza α
katalytické podjednotky DNA polymerázy α se skládá z 1468 aminokyselin (Tabulka 2). Proteinový konstrukt určený pro krystalizaci byl zkrácen na N-A C-termini (zbytky 349-1258), a proto postrádá CTD a jeho shluk (Obrázek 2). Konstrukt byl vykrystalizovala unliganded, v binární komplex s DNA/RNA hybrid oligonukleotid, a v ternárním komplexu s DNA/RNA a příchozí nukleotidů (Perera et al., 2013) (Obrázek 1).,

Tabulka 2. Kompilace DNA polymeráz rodiny B známé struktury.
Mechanismus Vyřazení Polymeráza
RNA/DNA oligonukleotid zachyceny v krystaly přijme-formulář konformaci, jak se očekávalo. Doména palce se zabývá více interakcemi s primerem RNA, a to jak prostřednictvím hydrofobních kontaktů, tak polárních interakcí (Perera et al., 2013)., Experimenty v roztoku ukázaly, že rozšíření primeru RNA o pol α je omezeno na 10-12 nukleotidů, což činí jednu otáčku šroubovice. Toto pozorování vedlo autory navrhnout mechanismus pro ukončení primer syntézy pol α, v němž ztráta specifických interakcí mezi palcem a RNA by vyvolat polymeráza se odpoutat od DNA/RNA oligonukleotid, a umožnit ruku do replikační polymerázy.,
Pohyby v Dlani Domény může Usnadnit Translokaci Pol α
S vykrystalizovala enzymu ve třech státech (apo, binární a ternární) umožnilo autorům překrytí všechny tři strukturální modely. Pol α je jediná eukaryotická rodina B DNA polymerázy, pro kterou byly všechny tři státy zachyceny v krystalové struktuře. Strukturální superpozice vyplynulo, že kromě dobře zdokumentované pohyby prstů a palce subdomény doprovodné substrátu závazné a nucleotidyl převodu, palm subdoménu sám prochází strukturální přeskupení (Perera et al.,, 2013). Autoři navrhují, že různé konformace palmové domény by mohly usnadnit translokaci pol α podél a mimo duplex RNA/DNA. Jak již bylo zmíněno výše, ztráta kontaktů do RNA strand, předpokládá se, vyvolat uvolnění nátěr, který pak bude k dispozici pro rozšíření pol δ nebo ε.,
Jiný Protein Složit v Inaktivované Exonuclease Subdomény
korektury činnost je zrušena v pol α, v důsledku mutace ve všech čtyřech carboxylates (Asp114/Glu116/Asp222/Asp327 v RB69 gp43 odpovídají Ser542/Gln544/Tyr644/Asn757 ve struktuře založené na zarovnání) (Tabulka 2). Navíc β-vlásenka motiv nalézt ve většině polymerázy B rodina (zbytky 246-267 v RB69 gp43) je nahrazena šikmými regionu v pol α (zbytky 667-676; 681-693) (Hogg et al., 2007)., Β-vlásenka je součástí exonuclease domény a bylo prokázáno, že v T4 a RB69 pols k účasti na rozdělení DNA primer mezi polymerázy a exonuclease aktivní místo (Reha-Krantz, 1988; Stocki et al., 1995; Hogg et al., 2007). Při absenci korektury není divu, že tento motiv nebyl v pol α zachován. Zbytky Jeho 684 a Phe 685 šikmými regionu v pol α zásobníku s thyminem a guanin základnu, respektive na pozice -3 a -2 v nepárové 5 end šablony (Perera et al., 2013)., Tak, v pol α regionu odpovídající β-vlásenka motiv přijímá různé fold (šroubovice vs. β prameny) a různé funkce (stabilizace nespárované oblasti prvku šablony, spíše než usnadnění aktivní místo přepínání). Od pol α je bez korektury činnost, vyvstává otázka, zda krátké oligonukleotidy jsou opraveny, a pokud ano, jakým DNA polymerázy. Zdá se, že korektura primerů syntetizovaných pol α se provádí pol δ (Pavlov et al., 2006a).,
DNA polymeráza δ
lidský pol δ se skládá ze čtyř podjednotek, zatímco Saccharomyces cerevisiae má tři (Gerik et al., 1998; Liu et al., 2000) (Tabulka 1). Kromě své funkce v replikaci DNA bylo prokázáno, že pol δ hraje roli při opravě a rekombinaci DNA (Hubscher et al., 2002; Lee et al., 2012; Tahirov, 2012). P12, nejmenší podjednotka v lidské pol δ a také podjednotka, která není vidět u pučících kvasinek, je degradována v reakci na poškození DNA (Lee et al., 2014). Katalytická podjednotka kvasnic pol δ (POL3) se skládá ze 1097 zbytků., Konstrukce použitá pro krystalizaci obsahuje zbytky 67-985 a postrádá tak CTD (Obrázek 1; Tabulka 2).
Třetí Kovových Iontů v Aktivním Místě Polymerázy
palm doména obsahuje tři konzervované carboxylates (Asp608, Asp762, a Asp764). Oba katalytické aspartáty, Asp608 a Asp764, kontaktují dva kovové ionty (Ca2+) v aktivním místě polymerázy oddělené 3,7 Å. Zajímavě byl pozorován třetí kov koordinovaný γ fosfátem přicházejícího nukleotidu a Glu802, s Glu800 v okolí., Mutace obou glutamátů na alanin přinesla polymerázovou variantu se sníženou účinností inkorporace pro správné i nesprávné nukleotidy (Swan et al., 2009). Na těchto pozicích aminokyselin, pol α a pol ε mají také karboxylát zbytky (pol δ Glu800/Glu802 odpovídají pol α Asp1033/Asp1035, a pol ε Glu945/Asp947). Zda tyto karboxyláty hrají podobné role v pol α a ε, se teprve zkoumá.,
High Fidelity a Korektury
Lidské pol δ je high-fidelity polymeráza, katalyzující nucleotidyl převod reakce s chybou frekvence 1 za 22,000 (Schmitt et al., 2009). Korektura zvyšuje věrnost polymerázy faktorem 10-100 (Mcculloch a Kunkel, 2008; Prindle et al., 2013). Pol δ má aktivní místo polymerázy a exonukleázy, oddělené asi 45 Å (Swan et al., 2009). DNA polymerázy s korekturou jsou schopny vnímat chybně zaznamenané nukleotidy kontaktováním menší drážky párů bází za místem vložení., Protein interaguje s univerzálními akceptory vodíkové vazby v N3 a O2 pozicích purinů a pyrimidinů (Seeman et al., 1976; Doublié et al., 1998; Franklin et al., 2001). Tyto vodíkové kontakty jsou zachovány, když základní pár přijme geometrii Watson-Crick a ztratí se v případě nesouladu. V RB69 gp43 se kontakty rozšiřují na první dva základní páry za rodící se základní pár (Franklin et al., 2001; Hogg et al., 2004, 2005). Kontakty jsou v polštině mnohem rozsáhlejší a rozšiřují se na pět párů bází po vložení (Swan et al.,, 2009), což by mohlo přispět k jeho vysoké věrnosti.
Jak bylo uvedeno výše, β-vlásenka segmentu z exonuclease doména hraje klíčovou roli v rozdělení DNA mezi polymerace a korektury míst v T4 a RB69 pols (Stocki et al., 1995; Hogg et al., 2007). V rb69 gp43 motiv β-vlásenky přijímá různé konformace, v závislosti na tom, zda byl komplex získán nepoškozenou DNA (Franklin et al., 2001; Zahn et al., 2007) nebo DNA obsahující poškození (Freisinger et al., 2004; Hogg et al., 2004)., Bylo plně vizualizováno kontaktování jak primeru, tak šablonových pramenů v komplexu s thyminovým glykolem (Aller et al., 2011). Podobně, β-vlásenka v pol δ vyčnívá do hlavní drážky DNA a působí jako klín mezi double-stranded DNA a single-stranded 5 end šablony pramen, který je stabilizován pomocí dvou aromatických reziduí Phe441 a Tyr446 (Obrázek 1) (Swan et al., 2009). Poloha β vlásenky odpovídá roli při aktivním přepínání místa.,
Interdomain Kontakty a Věrnosti
Mutace zapojené v rakovině jsou většinou nacházejí v exonuclease domény pol δ a ε, s důrazem na rozhodující úlohu korektury ve snížení výskytu mutace (Church et al., 2013; Henninger and Pursell, 2014). Jedna mutace v lidských kolorektálních nádorových buňkách se lokalizuje na doménu prstů, r689w. analogická mutace v kvasinkách (R696W) má za následek mutační fenotyp (Daee et al., 2010)., Mutace v blízkosti Arg696 ve vysoce konzervovaným motivem B prstů subdoménu kvasinek pol δ (A699Q) také výsledky v mutator fenotyp. Tato oblast prstů je v těsné blízkosti NTD. Mutující Met540 z NTD alanin ruší mutator fenotyp A699Q, které dokládají, že interakce mezi prsty a NTD může mít vliv na věrnost polymerázy (Prindle et al., 2013)., Podobně jako v T4 a RB69 pols NPL základní motiv, který zahrnuje zbytky z N-terminální a palm domény, je v kontaktu s prsty domény a bylo prokázáno, že stabilizovat polymeráza-DNA komplexy (Li et al., 2010).
DNA Polymeráza ε
katalytické podjednotky DNA polymeráza ε je produkt velmi velký gen (2222 aminokyselin v kvasinkách; 2286 lidí), a je jen třetí co do velikosti po polymerázové ζ (také člen rodiny B) a pol θ, rodina polymerázové (3130 a 2590 aminokyselin, respektive u lidí) (Lange et al.,, 2011; Hogg and Johansson, 2012) (Obrázek 1; Tabulka 2). Pol ε je dvakrát větší než pol δ a skládá se ze dvou oblastí tandemové polymerázy/exonukleázy. N-terminální segment má jak polymerázu, tak korekturu, zatímco segment C-terminálu je inaktivován. Dva moduly exonukleázy-polymerázy jsou vzdáleně příbuzné (Tahirov et al., 2009). I když inaktivovaná segmentu se předpokládá, hrát strukturní roli při replikaci, dvě skupiny byly schopny krystalizovat katalyticky aktivní pol ε konstrukce (zbytky 1-1228; 1-1187) chybí celý C-terminální modul (Hogg et al.,, 2014; Jain et al., 2014a). Obě krystalové struktury byly ternárního komplexu polymerázy, dna primeru / šablony a příchozího nukleotidu.
nová doména Procesivity vycházející z domény Palm
pol ε se liší od pol δ tím, že nevyžaduje dna posuvnou svorku PCNA pro vysokou procesivitu (Hogg a Johansson, 2012). Palmová doména pol ε je podstatně větší (380 reziduí) než u pol α nebo δ (175 a 203 reziduí)., Nedávné pol ε krystalové struktury vyplynulo, že inzerce v dlani domény společně tvoří novou doménu skládající se ze tří β prameny a dvě šroubovice (zbytky 533-555; 682-760) (Hogg et al., 2014; Jain et al., 2014a) (Obrázek 1; tabulka S1). Odstranění zbytků 690-751 vedlo k variantě se sníženou aktivitou polymerázy. Kromě toho mutace pozitivně nabitých zbytků (His748, Arg749 a Lys751) umístěných v blízkosti fosfátové páteře ovlivnila procesivitu enzymu (Hogg et al., 2014)., Další doména pocházející z dlaně byla tak pojmenována podle své funkce jako doména procesivity nebo P. Základem domény P je kovové vazebné místo (viz níže) (Hogg et al., 2014; Jain et al., 2014a, b).
Železo, Síra Clusteru v Polymerázové Domény
Nečekaně řešení studie odhalila, že katalytická podjednotka kvasinkové polymeráza ε sám obsahuje clusteru v jeho polymerázové fold (Jain et al., 2014b), kromě clusteru v CTD (Obrázek 2; Tabulka 2)., Druhá skupina v pol ε naznačuje, že tato polymeráza může být citlivější na oxidační stres (Jain et al., 2014b). Krystalové struktury pol ε však neodhalily cluster v polymerázové doméně (Hogg et al., 2014; Jain et al., 2014a; Zahn a Doublié, 2014). Dva z cysteinových zbytků jsou ve strukturálních modelech narušeny a výsledné kovové vazebné místo se zdá vázat zinek (Hogg et al., 2014; Jain et al., 2014a). Substituce a nepůvodním zinkem v kovově vázaných proteinech není neobvyklá (Netz et al., 2012) jako klastry jsou labilní., Vizualizace uvnitř polymerázové domény pol ε může vyžadovat anaerobní podmínky.
Krátké β-Vlásenka Motiv v Exonuclease Domény
V každém DNA polymeráza přechovávání obě polymerázy a exonuclease činnosti vázané DNA je v rovnováze mezi dvě aktivní centra (Beechem et al., 1998). Koncentrace příchozí nukleotidů a přítomnost poškození základny nebo mispair jsou dva faktory, které ovlivňují přenos DNA polymerázy aktivovat stránky korektury aktivní stránky., Polymerázy sledovat drobné drážky straně nově vzniklých párů bází a komunikovat s univerzální H vazba akceptory, O3, N2, jako způsob, jak kontrolovat pro nesoulad (Seeman et al., 1976; Franklin et al., 2001). Unikátní vlastností pol ε je kontakt na hlavní drážkovou stranu rodícího se základního páru přes zbytek z exonukleázové domény Tyr431. Další analýza je oprávněna objasnit potenciální roli tohoto tyrosinu ve vysoké věrnosti pol ε.,
V pol δ β-vlásenka segmentu vloží se na DNA a působí jako klín mezi jednovláknové a dvouvláknové DNA (Swan et al., 2009). V E. coli DNA pol II vložení β barelu posune polohu β vlásenky takovým způsobem, že polymerace je upřednostňována před korekturou (Wang a Yang, 2009). Tato modifikace pravděpodobně umožňuje této polymeráze provádět rozšíření syntézy transleze., Od pol ε je přesné DNA polymerázy předpoklad, než znalost krystalové struktury by se stát, že β-vlásenka by měl být blíže k pol δ než E. coli Pol II. Překvapivě, β-vlásenka s motivem pol ε je zkrácen, příliš krátká na to, obraťte se na DNA (Obrázek 1). Který proteinový motiv by tedy mohl usnadnit aktivní přepínání stránek při snímání nesprávného chování? Doména P je dobrým kandidátem, protože má kontakty na prameny primerů i šablon; zbytky z domény P by mohly cítit chyby replikace, a tak mohou pomoci usnadnit aktivní přepínání stránek.,
Závěry
Všechny tři eukaryotní replikační DNA polymerázy používat společný B-rodina složit, a každý polymeráza má začleněny upravené konstrukční prvky, které jsou unikátní a na míru pro každý polymeráza je konkrétní funkci (např. přidání processivity domény v pol ε, processive polymerázy, která nepoužívá PCNA, nebo upravené regionu, kontaktování 5 end šablony v pol α, polymeráza postrádá proofreading aktivitu). Záhyb polymeráz rodiny B je vhodný pro vysoce věrné, replikativní polymerázy., Překvapivě je však také používán translezními polymerázami. Eukaryotická pol (nebo REV3L) je 353 kDa polymeráza, která funguje při syntéze transleze a zdá se, že potlačuje tumorigenezi (Wittschieben et al., 2010; Lange et al., 2011; Zahn et al., 2011; Hogg and Johansson, 2012; Sharma et al., 2013). Struktura E. coli Pol II odhalil změny v NTD, které ovlivňují pozici β-vlásenka z exonuclease domény, a tedy rozdělení DNA mezi polymerace a korektury míst (Wang a Yang, 2009)., Struktura pol ζ může odhalit podobné úpravy, které mění složit zaměstnán high-fidelity, replikační polymerázy k vykreslení enzymu méně věrný a schopen provádět translesion synthesis.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Potvrzení
Tato práce byla podpořena grantem od National Institutes of Health (NCI R01 CA 52040).
doplňkový materiál
© 2021 Tombouctou
Šablonu vytvořil Anders Noren — Nahoru ↑
















Napsat komentář