Řízení mateřské aloimunizace
je pravidlem, sériové mateřské titry protilátek jsou sledovány až do kritického titru 1:32, což znamená, že vysoké riziko fetální hydrops bylo dosaženo. V tomto okamžiku plod vyžaduje velmi intenzivní sledování příznaků anémie a hydrops plodu., V Kell aloimunizace, hydrops může nastat při nízké titry mateřských protože potlačil tvorbu červených krvinek, a tedy titr 1:8 bylo navrženo jako kritické. Hodnoty delta-od 450 jsou proto také nespolehlivé při předpovídání závažnosti onemocnění při kellově alloimmunizaci.
titry matek nejsou užitečné při předpovídání nástupu fetální anémie po prvním postiženém těhotenství. Velké rozdíly v titru lze pozorovat u stejného pacienta mezi různými laboratořemi a novější gelová technika produkuje vyšší výsledky titru než starší metoda zkumavky., Pro stanovení kritického titru by proto měla být použita standardní metodika zkumavek a změna více než 1 ředění představuje skutečné zvýšení titru mateřských protilátek. U všech protilátek odpovědných za hemolytické onemocnění novorozence (HDN) je 4násobné zvýšení jakéhokoli titru protilátek obvykle považováno za významnou změnu, která vyžaduje hodnocení plodu.
Pokud je uvedeno, amniocentéza může být provedena jak brzy jako 15 týdnů těhotenství (zřídka potřebné v první postižené těhotenství před 24. týdnem těhotenství) k určení genotypu plodu a posoudit závažnost., Mateřské a otcovské krevní vzorky by měly být zaslány do referenční laboratoře s amniotické vzorku tekutiny k odstranění falešně pozitivních výsledků (z mateřské pseudogene nebo Ccde gen) a falešně negativní výsledky (od přestavby na RHD genu lokusu v otci).
stanovení fetálního Rh-genotypu v mateřské plazmě se stalo rutinou v mnoha evropských zemích a je nabízeno ve Spojených státech., Fetální DNA bez buněk představuje 3% celkové cirkulující mateřské plazmatické DNA, Nachází se již 38 dní těhotenství a je odvozena od apoptózy placentární cytotrofoblastové vrstvy. Průměrný poločas cirkulující fetální DNA je v průměru méně než 30 minut, a mateřské plazmě je podroben filtraci a microcentrifugation odstranit všechny buněčné elementy před testováním. To eliminuje falešně pozitivní výsledky z vyrytých fetálních buněk předchozích těhotenství v mateřských lymfoidních orgánech.,
fetální DNA bez buněk je podrobena řetězové reakci polymerázy v reálném čase (PCR) za přítomnosti sekvencí specifických pro Gen RHD a bylo zjištěno, že je přesná v 99, 5% případů. Gen SRY (u mužského plodu) a DNA polymorfismy v obecné populaci (u ženského plodu) se používají jako vnitřní kontroly k potvrzení fetálního původu DNA bez buněk. Panel 92 jednonukleotidových polymorfismů (SNP) je porovnáván mezi mateřským vzorkem z buffy coat a plazmy., Rozdíl více než 6 SNP potvrzuje přítomnost fetální DNA a platnost testu u ženského plodu. Falešně negativní výsledky jsou nejvíce nežádoucí a následné jsou způsobeny částečnými nebo slabými fenotypy D. Jsou detekovány pomocí alespoň dvou exon primerů specifických pro RHD a běží v duplikátech.
Naštěstí, cell-free fetal DNA testování pro stanovení genotypu pro jiné červených krvinek antigeny c,c, e, E a Kell je nyní také zjištěno, že být vysoce spolehlivé a přesné.,
sériová amniocentéza se zahajuje v 10-14 denních intervalech, aby se sledovala závažnost onemocnění u plodu. Všechny pokusy by měly být provedeny, aby se zabránilo transplacentární průchod jehly, což může vést k fetomaternální hemoragie (FMH) a další nárůst titru protilátek. Sériová delta-od 450 hodnoty jsou vyneseny na Queenan grafu nebo rozšířené Liley grafu vyhodnotit riziko plodu hydrops. Včasná ultrasonografie se provádí za účelem stanovení správného gestačního věku., Časté ultrasonografické sledování se také provádí za účelem posouzení pohody plodu a detekce mírné anémie a časných příznaků hydrops.
maximální systolická střední mozková tepna (MCA) Dopplerova rychlost se ukázala jako spolehlivý screeningový nástroj pro detekci fetální anémie a nahradila amniocentézu. MCA je snadno vizualizovat s color flow Doppler; pulsní Doppler je pak použit k měření maximální systolické rychlosti jen distální k jeho rozdvojení z vnitřní krční tepny., Protože rychlost MCA se zvyšuje s postupujícím gestačním věkem, výsledek je zaznamenán v násobcích mediánu (maminky). V nedávných studiích byla prokázána citlivost na detekci středně těžké a těžké fetální anémie 100% s falešně pozitivní mírou 10% při 1,5 MOM. Bylo prokázáno, že snižuje potřebu invazivních diagnostických postupů, jako je amniocentéza a Kordocentéza, o více než 70%.
studie MCA Doppler mohou být zahájeny již v 18. týdnu těhotenství, ale po 35.týdnu těhotenství nejsou spolehlivé., Používá se také k časování následné transfuze plodu a k diagnostice anémie z více příčin, například při transfuzi dvojčat. Sklon MCA od 3týdenních hodnot se nyní používá k předpovědi rizika plodu pro těžkou anémii (viz obrázek níže).
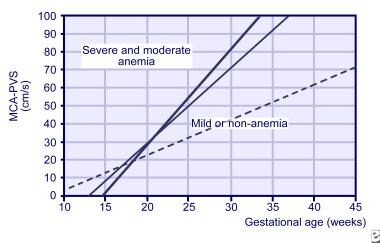 Svahy na vrchol systolické rychlosti na střední mozkové tepny (MCA) za normálních plodů (tečkovaná čára), mírně anemický plodů (tenká čára), a tvrdě anémie plodu (silná čára).,
Svahy na vrchol systolické rychlosti na střední mozkové tepny (MCA) za normálních plodů (tečkovaná čára), mírně anemický plodů (tenká čára), a tvrdě anémie plodu (silná čára)., se získáním zkušeností s prováděním studie MCA Doppler byla sériová amniocentéza pro detekci fetální anémie použita v menší míře.
během období, kdy intrauterinní peritoneální transfúze byla jediným prostředkem léčby, byli novorozenci rutinně dodáváni po 32 týdnech těhotenství. Tento přístup vedl k vysokému výskytu onemocnění hyalinní membrány a výměnných transfuzí., S příchodem intravaskulární transfuze (IVT) v děloze, obecný přístup k těžce postiženého plodu je provést IVT, jak je požadováno až do 35 týdnů těhotenství, s dodávkou plánované na termín. Stanovení plicní zralosti je obtížné v těchto plodů, protože kontaminace plodové vody se zbytkovou krev při transfuzi; nicméně, v případě, že dodávka je plánována před 34 týdnů těhotenství, mateřské podání steroidů pro zvýšení fetální plicní zralosti je uvedeno.,
kromě toho, nadbytek plodové vody hladina bilirubinu způsobit falešné nadmořská výška na depolarizace fluorescence TDx fetální plicní zralosti test, verze II (TDX-FLMII); proto další testy k určení fetální plicní zralosti, by měly být použity, jako je infračervená spektroskopie, lamelární tělo spolehnout, phosphatidylglycerol kvantifikaci nebo lecitin/sfingomyelin (L/S) poměr.
Liley poprvé popsal intraperitoneální transfuzi (IPT) v roce 1963. Tuohy jehla se zavádí do fetální peritoneální dutiny pod ultrasonografickým vedením., Epidurální katétr je provlečen jehlou. Do peritonea plodu se injektuje rentgenové médium. Správné umístění je potvrzeno vymezení mimo střeva nebo pod membránou nebo difúzí ve fetálním ascitu.,ss než 4-dny-starý, skupinu, Rh-negativní, Kell-negativní, leukoreduced, ozáření 25 Gy, aby se zabránilo reakci štěpu proti hostiteli, a cross-uzavřeno s mateřského séra jsou injekčně v 10-mL alikvotní objem se vypočítá podle následujícího vzorce:
IPT objem = (těhotenství v týdnech – 20) × 10 mL
Zbytkové hemoglobinu (Hb) v plodu se odhaduje na povolit pro správné mezery IPT a výběr z těhotenství, porodu podle následujícího vzorce:
Hb g/dL = 0.,85/125 × a/b × 120 – c/120
Ve vzorci, je množství dárců, RBC, Hb transfuze, b je odhad tělesné hmotnosti plodu, a c je interval ve dnech od doby transfuze do doby dárce Hb odhad.
IPT se opakuje, když se odhaduje, že fetální Hb klesla na 10 g / dl. Obvykle se druhý IPT provádí 10 dní po první transfuzi, aby se zvýšila Hb nad 10 g / dl. Poté se provádí další transfúze každé 4 týdny až do doby plánovaného porodu v těhotenství 34-35 týdnů., Fetální diafragmatické pohyby jsou nezbytné k tomu, aby došlo k absorpci RBC. Tento přístup nemá žádnou hodnotu pro skomírající plod. Mateřské komplikace zahrnují infekci a transplacentální krvácení, zatímco fetální komplikace jsou overtransfuze, exsanguinace, srdeční tamponáda, infekce, předčasný porod a štěp versus hostitelská nemoc. Míra přežití po IPT se přiblížila přibližně 75% pomocí ultrasonografie.,
přímá IVT se stala preferovanou cestou fetální intervence kvůli vyšší míře komplikací a omezené účinnosti IPT u hydropického plodu. Rodeck poprvé úspěšně provedl IVT v roce 1981. S ultrazvukového navádění, 20-22 gauge jehly je zaveden do pupeční žíly v kabelu vložení do placenty nebo do jeho intrahepatální část, a fetální krevní vzorek se získává. Vzorek krve je potvrzen jako plodový původ rychlým alkalickým denaturačním testem., Jsou prováděny všechny příslušné fetální testy (např. krevní typ, přímý test protilátek, počet retikulocytů, počet krevních destiček, hladina Hb, hladina Hct, hladina albuminu v séru, hladina erytropoetinu). Pokud je hladina Hb menší než 11 g/dL nebo pokud je hladina Hct nižší než 30%, spustí se IVT. Poloha jehly je potvrzena zaznamenáním turbulence ve plodové nádobě při injekci fyziologického roztoku. Plod je často ochromena pancuronium a vzhledem k tomu, fentanyl 10 mcg/kg, aby se zabránilo posunutí jehly o pohyby plodu., Mateřské léky se liší pouze od lokálního anestetika, od rutinního indometacinu a vědomé sedace až po spinální epidurální analgezii.
transfuze se provádí v 10-mL alikvoty na objem přibližně 50 mL/kg odhadované tělesné hmotnosti pomocí ultrasonografie nebo dokud Hct úrovni 40% je dosaženo. Postup je okamžitě přerušen, pokud je zaznamenána srdeční dekompenzace na ultrasonografických nálezech., Těžce anemické plody netolerují akutní korekci jejich Hct na normální hodnoty a počáteční Hct by neměla být zvýšena o více než 4krát v době první IVT. Poté by měly být sledovány každé 2-7 dní. IVT se opakuje, když dosáhne hodnoty, která odráží kritickou anémii u plodu. Lze očekávat ztrátu 1% transfuzovaných buněk denně.
Některá centra provést opakované transfuze v intervalech 10 dní, 2 týdny, každé 3 týdny. Jiné transfuze založené na předpokládaném poklesu fetálního hemoglobinu o 0, 4 g/dL/den, 0, 3 g/dL/den a 0.,2 g / dL / den pro první, druhý a třetí transfuzní intervaly. Maximální systolická rychlost MCA byla použita k časování druhé transfuze s prahem 1,32 MOM. Po první intrauterinní transfuze, přítomnost červených krvinek u dospělého hemoglobinu potlačit tvorbu červených krvinek a zlepšit dodávku kyslíku, který je zodpovědný za špatnou korelaci mezi špičku MCA rychlosti a závažnosti fetální anémie. Některá centra našla příznivý účinek kombinované IVT a IPT transfúze na interval pro opakování transfúze.,
kromě komplikací IPT byla během IVT hlášena přechodná fetální bradykardie, hematom šňůry, komprese pupeční žíly a úmrtí plodu. Nicméně, IVT má mnoho výhod, včetně okamžité korekci anémie a usnesení hydropsu plodu, snížená sazba hemolýze a následné hyperinzulinémie, a akcelerace růstu plodu pro nonhydropic plodů, které jsou často retardovaný růst. IVT je jediný zásah, který je k dispozici pro skomírající hydropické plody a ty s přední placentou. Riziko ztráty plodu je asi 0,8% u IVT versus 3.,5% na postup pro IPT a celková míra přežití je 88%.
v Poslední době se promyje mateřské Erytrocyty byly úspěšně použity jako zdroj antigen-negativní červené Krvinky v případě vzácných neslučitelnosti ale také byly běžně používány, protože výhod, jako je snížené riziko senzibilizace na nové červených krvinek antigeny, delší cirkulující half-life je svěží, a snížil riziko přenosu virových agens. Matka může darovat jednotku červených krvinek po prvním trimestru.,
V případě plicní nezralosti a delta-OD 450 v postižené zóně Queenan křivky, perorální podání 30 mg fenobarbitalu na matku 3 krát za den, následuje indukce v jednom týdnu, snižuje potřebu výměnná transfuze v postižené novorozence. Vynikající algoritmy pro řízení prvního postiženého těhotenství a těhotenství u matky s dříve postiženým plodem jsou popsány v recenzi Moise (viz obrázky níže).
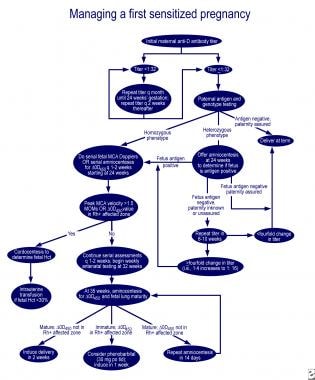 řízení prvního postiženého těhotenství.,
řízení prvního postiženého těhotenství., 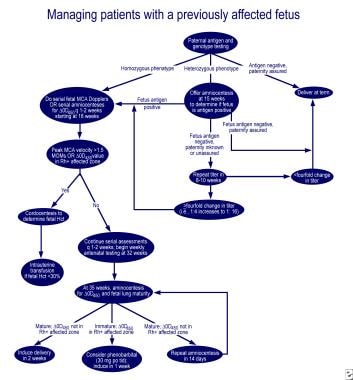 řízení těhotných žen s dříve postiženým plodem.
řízení těhotných žen s dříve postiženým plodem. Počáteční pokusy potlačit Rh protilátek u Rh hapten, Rh-pozitivní RBC stroma a správa promethazine byly neúspěšné. Rozsáhlé plazmaferéza s částečnou náhradou pomocí 5% albumin (terapeutické plazmatické exchange) a intravenózní imunoglobulin (IVIG) nebo podávání IVIG na 1 g/kg tělesné hmotnosti týdně bylo prokázáno, že středně účinný., Mechanismus účinku se zdá být blokáda Fc receptorů v placentě, snížení protilátek dopravy přes plod, Fc receptory fagocytů v plodu retikuloendoteliálního systému a zpětné vazby inhibice mateřské syntéza protilátek. Cytotoxicita a rebound zvýšení koncentrace protilátek, změna placentárního průtoku krve během procedury a poporodní krvácení však byly zaznamenány po výměně plazmy.,
více nedávné retrospektivní studii zahrnující 5 těhotné ženy s těžkou formou HDFN vzhledem k RBC aloimunizace hlášeny úspěšné léčbě s kombinovaným režimem terapeutické plazmatické exchange, IVIG, a intrauterinní transfuze (IUT) brzy v těhotenství. Ženy památek, 3 plazma exchange postupy během 10-13 týdnů těhotenství, po týdenní infuze IVIG; plody obdržel RBC jednotek, které plně odpovídá mateřský fenotyp D, C, E, K, Fy, Jk, a S antigen skupiny. Všechny ženy porodily zdravé kojence ve 33-38 týdnech těhotenství.,
tyto techniky však pouze odkládají potřebu perkutánního odběru pupeční krve (PUBS) a IVT až do 20-22 týdnů těhotenství, kdy lze tyto postupy provádět s přijatelnějším rizikem. Přehled použití IVIG ukazuje jeho užitečnost při prevenci nástupu plodových hydrops a při zpoždění potřeby IUT., Tak, kombinovaný přístup plazmaferéza, která začíná na 12 týdnů těhotenství 3 krát v tomto týdnu, následována IVIG v nasycovací dávce 2 g/kg po třetím plazmaferéza, a pak pokračoval IVIG 1 g/kg/týden do 20. týdne těhotenství bylo navrženo pro rizikové plodů před 20 týdnů těhotenství a může být také použit později v těhotenství, pokud IVT nemůže být proveden, nebo pokud hydrops nereaguje na IVT.,
Jedna zpráva uvedla, že léčba plodů s těžkou aloimunizace pomocí IVT v kombinaci s fetální IVIG terapie na 1 g/kg/dávku od třetí IVT pomohl ve snížení frekvence IVT a zlepšení známky hydropsu. V případě, že zpráva ukazuje, úspěšná léčba těžké anémie a hydropsu v plodu s aloimunizace vzhledem k anti-M protilátek s plodu intraperitoneální IVIG injekce 2 g/kg týdně, počínaje 30.týdnu. Jednalo se však o případovou zprávu a je zapotřebí randomizované kontrolované studie, než se to může stát standardem péče.,
Podobné režimy testů a léčby jsou používány v řízení těhotenství ovlivněna nonRhD aloimunizace, jako je anti-Rhc, anti-K (K1), a anti-M. Jakmile matka je diagnostikována protilátka spojená s hemolytické onemocnění, nepřímý Coombsův titr se provádí, spolu s otcovské testování zapojených antigen a zygosity. Titry matek se opakují (měsíčně až do 28 týdnů těhotenství a poté každé 2 wk), dokud není dosaženo prahové hodnoty pro fetální anémii (1:8 Pro Kell a 1:32 pro odpočinek).,
typizace fetálního antigenu se provádí pomocí amniocentézy nebo fetální DNA bez buněk v mateřské plazmě, pokud se zjistí, že otec je heterozygotní (100% pro K1, 65% Pro M). Když plod je známo, že je antigen pozitivní, dohledu za závažné fetální anémie se provádí s týdenní TRANSKRANIÁLNÍ Doppler screening jak již 16-18 týdnů a IUT se provádí, pokud je větší než 1,5 MÁMA s doručením do 38 týdnů těhotenství.
bylo prokázáno, že alloantilátky matek na otcovské leukocyty vedou k blokádě Fc a ke snížení závažnosti fetální hemolytické anémie., To může být použito v budoucnu.
Řízení citlivé novorozence
Mírné hemolytické onemocnění představuje 50% novorozenců s pozitivní přímý test na protilátky výsledků. Většina těchto novorozenců nejsou chudokrevné (kabel hemoglobin >14 g/dL) a mají minimální hemolýza (kabel bilirubin < 4 mg/dL). Kromě rané fototerapie nevyžadují žádné transfuze. Tito novorozenci jsou však vystaveni riziku vzniku těžké pozdní anémie o 3-6 týdnů života. Proto je důležité sledovat jejich hladiny Hb po propuštění z nemocnice.,
mírné hemolytické onemocnění představuje přibližně 25% postižených novorozenců. Mírné hemolytické onemocnění novorozence je charakterizováno mírnou anémií a zvýšenou hladinou bilirubinu šňůry. Tyto děti nejsou klinicky žloutnutí při narození, ale rychle rozvíjet nekonjugované hyperbilirubinemie v prvních 24 hodinách života. Periferní nátěr vykazuje četné nukleované RBC, snížené krevní destičky a příležitostně velké množství nezralých granulocytů., Tito novorozenci mají často hepatosplenomegalii a jsou vystaveni riziku vzniku bilirubinové encefalopatie bez odpovídající léčby. Obvykle se vyžaduje včasná výměnná transfúze s čerstvými RBC typu o Rh-negativní s intenzivní fototerapií. Použití IVIG v dávkách 0,5-1 g/kg v režimu jedné nebo více dávek dokázalo účinně snížit potřebu výměnné transfúze.,
prospektivní randomizované kontrolované studie ukázaly, brzy vysoké dávky IVIG 1 g/kg po 12 hodinách ve věku ke snížení trvání fototerapie a pobyt v nemocnici, a aby se zabránilo výměnná transfuze u novorozenců se středně těžkou-těžkou Rh isoimmunization. Tito novorozenci jsou také vystaveni riziku vzniku pozdní hypooregenerativní anémie v dětství po 4-6 týdnech života. Jedna randomizovaná dvojitě zaslepená placebem kontrolovaná studie však neprokázala přínos profylaktické IVIG terapie 0.,75 g / kg do 4 hodin věku u těžce postižených novorozenců, kteří byli léčeni intrauterinní transfuzí pro isoimunizaci Rh.
závažné hemolytické onemocnění představuje zbývajících 25% alloimunizovaných novorozenců, kteří jsou při narození mrtvě narozeni nebo hydropičtí. Fetální hydrops je převážně způsoben syndromem kapilárního úniku v důsledku tkáňové hypoxie, hypoalbuminémie sekundární k jaterní dysfunkci a vysokého srdečního selhání při anémii., Asi polovina těchto plodů se stává hydropickou před 34 týdny těhotenství a vyžaduje intenzivní sledování a řízení alloimmunizované gestace, jak je popsáno výše. Mírné hydrops zahrnující ascites obrátí s IVTs pouze v 88% případů s lepší přežití, ale závažné hydrops což způsobuje pokožku hlavy, edém a vážné ascites a pleurální výpotek, naopak v 39% případů a jsou spojeny se špatnou přežití.
řízení Abo nekompatibility
léčba hyperbilirubinémie je hlavním problémem u novorozenců s Abo nekompatibilitou., Kritéria pro výměnnou transfuzi a fototerapii jsou podobná kritériím používaným při alloimunizaci Rh. IVIG byl také velmi účinný při podávání brzy v průběhu. Cín (Sn) porfyrinu silný inhibitor hemoxygenáza je enzym, který katalyzuje rychlost limitující krok v produkci bilirubinu z hemu, bylo prokázáno, že snížení produkce bilirubinu a snížit potřebu pro transfúzi a doba trvání fototerapie novorozenců s ABO neslučitelnosti.
protoporfyrin cínu nebo zinku nebo mezoporfyriny byly studovány u novorozenců., Musí být podáván intramuskulárně v dávce podle tělesné hmotnosti, a jejich účinnost se zdá být závislé na dávce ve všech těhotenství. Mezi jejich možné toxické účinky patří fotosenzitizace kůže, nedostatek železa a možná inhibice produkce oxidu uhelnatého. Jejich použití u RH hemolytického onemocnění novorozence nebylo hlášeno. Jejich rutinní použití zatím nelze doporučit kvůli nedostatku dlouhodobých bezpečnostních údajů.
















Napsat komentář