US Pharm. 2010;35(5):36-41.
vztah mezi diabetes mellitus (DM) a demence je nepopiratelné, s četné studie k závěru, že DM zvyšuje riziko úbytku kognitivních funkcí a demence, včetně Alzheimerovy choroby (AD).1-5 nejen, že DM zvyšuje riziko demence, ale ve skutečnosti zvyšuje rychlost vývoje demence dva až trojnásobně.,3 mechanismus tohoto poškození není zcela znám, ale to je předpokládal, že hyperglykémie, inzulinové rezistence, oxidačního stresu, produkty pokročilé glykace a zánětlivých cytokinů souhrnně vést ke kognitivní dysfunkci.5 ve skutečnosti byl diabetes popsán jako „zvláštní druh zrychleného stárnutí“ v roce 1976 kvůli mnoha souvisejícím komplikacím.,5 zřejmé překrývání mezi DM a demence vedlo k tvrzení, že REKLAMA není pouze neurologické onemocnění, ale spíše neuroendokrinní poruchy, s Steen et al ražení termín typ 3 diabetes popsat tento hybridní onemocnění.,6.
Přehled Inzulínové Rezistence/Poruchou Glukózové Tolerance
Patofyziologie: Obě porucha glukózové tolerance, definovaná jako plazmatické glukózy 140 mg/dL na 199 mg/dL po orální glukózový toleranční test—a zhoršené glukózy nalačno definované jako půstu plazmatické glukózy 100 mg/dL až 125 mg/dL—jsou diagnostické prediabetes (předchůdce typu, DM 2 ), jako je hemoglobin A1C 5,7% na 6,4%.7 patofyziologie prediabetes je stejný jako u T2DM, což je diagnostikována po půstu krevní glukózy 126 mg/dL nebo vyšší, nebo A1C 6.,5% nebo více (zkouška opakovaná pro potvrzení).7 V obou podmínek, inzulínová rezistence se vyvíjí v periferních tkáních, kde inzulín je nezbytné pro vychytávání glukózy (zejména svalové, jaterní a tukové), a slinivky břišní je nucena dodávat stále více inzulínu k překonání tohoto odporu.8 v této fázi jsou pacienti často hyperinzulinemičtí; v průběhu času však pankreas nemůže splnit požadavky tkání a beta buňky pankreatu produkující inzulín pomalu selhávají a produkují stále méně inzulínu.,8 bez dostatečného množství inzulínu se koncentrace glukózy v krvi zvyšují, což vede k prediabetes a až u 70% pacientů s prediabetes T2DM.9 komplikace hyperglykémie je mnoho a zahrnují zvýšené riziko makrovaskulární komplikace (včetně infarktu myokardu, cévní mozkové příhody a onemocnění periferních cév) a mikrovaskulárních komplikací (včetně nefropatie, neuropatie a retinopatie).7
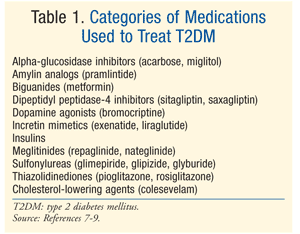
léčba: k léčbě DM existuje mnoho terapií., Počáteční léčba jak prediabetes, tak T2DM je modifikace životního stylu zahrnující dietu, cvičení a hubnutí.7 Americká Diabetická asociace (ADA) také doporučuje zvážit metformin u pacientů s prediabetes, u kterých je vysoké riziko vzniku diabetu.7 Metformin se doporučuje jako počáteční farmakologická léčba T2DM.7 k dosažení ada glykemických cílů je často zapotřebí další farmakologická léčba, včetně A1C 7%.,7 Tam jsou četné třídy léků pro T2DM (TABULKA 1), a výběr agenta, aby normalizovat hladinu glukózy v krvi závisí na mnoha pacienta a léky-specifické faktory. Je důležité si uvědomit, že mnoho pacientů s T2DM bude nakonec vyžadovat exogenní inzulín k dosažení a udržení eugencémie, protože funkce beta-buněk postupně klesá.
Přehled AD
Patofyziologie: AD je nejčastější formou demence u starších dospělých, což představuje 60% až 80% všech případů.,10 dva histopatologické znaky AD jsou neuritické plaky a neurofibrilární spleti.11 plaků se skládá z nerozpustného beta-amyloidního proteinu. Spleti, které jsou intracelulární, se skládají z fosforylovaného proteinu tau. Tau protein je důležitý pro mikrotubulovou sestavu, a když je tento protein abnormálně fosforylován, neuronální funkce je přerušena. Neurofibrilární spleti nejčastěji postihují cholinergní neurony.12 kromě toho narušení hlavního excitačního neurotransmiteru, glutamátu, přispívá k patologii AD., V INZERÁTU, je overactivation glutamátu, což signalizuje proces známý jako excitotoxicity, což vede k tvorbě plaku, hyperfosforylací tau proteinu, a buněčné smrti.12 V souhrnu, excitotoxicitu a tvorbu neuritic plaky a neurofibrilární klubka narušení neurotransmiterových drah, což má za následek učení a poruchy paměti spojené s AD.
léčba: dostupné farmakologické terapie schválené FDA pro AD jsou shrnuty v tabulce 2.,11,12, Zatímco tam je ještě hodně naučit, s ohledem na terapie, které léčí nebo změnit patologie AD, v současné době k dispozici terapie zahrnují použití acetylcholinesterázy inhibitory, z nichž jsou tam čtyři, a N-methyl-d-aspartát receptorů memantin.

Inzulínu a Mozek
i když to je nezbytné pro transport glukózy do periferních tkání, inzulín se nezdá být potřebné pro transport glukózy do mozku nebo cerebrální metabolismus glukózy., Zatímco transport glukózy do mozku není závislý na inzulínu, inzulínu probíhá přes hematoencefalickou bariéru (BBB) na inzulínové receptory–zprostředkované procesy přepravy.13 Tento transportní mechanismus je saturovatelnou, na delší dobu nadměrné koncentrace inzulínu (hyperinzulinémie) na periferii, jako ty, které viděl v prediabetes a T2DM, to receptorem zprostředkovaný transportní mechanismus snižuje počet, čímž se snižuje transport inzulínu v mozku a mozkomíšním moku.,
kromě toho, inzulín, insulin-like růstový faktor typu 1 (IGF-1) je přítomen v mozku a je potřebný pro normální růst a funkci centrálního nervového systému (CNS).14 receptorů inzulínu a IGF-1 se nachází v mozku na neuronech a astrocytech (buňky ve tvaru hvězdy v CNS, které pomáhají podporovat neurony v mozku). Dvě oblasti mozku, které jsou rozhodující pro učení a paměť, hippocampus a hypotalamus, obsahují vysoké koncentrace inzulínových receptorů.5 u potkanů bylo prokázáno, že intracerebroventrikulární podávání inzulínu zvyšuje paměť.,15 kromě toho bylo zjištěno, že intranazální podávání inzulínu u lidí zvyšuje výkon paměti.16 Jak již bylo uvedeno výše, inzulín není nutný pro metabolismus mozkové glukózy; v mozku však mohou existovat specifické oblasti, ve kterých inzulín spouští metabolické procesy zahrnující glukózu. Ve studiích na potkanech, na inzulín bylo prokázáno, že vlivem využití glukózy v hypotalamus a locus coeruleus, dvě oblasti, které jsou důležité pro učení a paměť.,17 Učení také bylo prokázáno, že k usnadnění zvýšené expresi CNS inzulinové receptory, což vede k předpokladu, že přítomnost a aktivita inzulínu v mozku přispívat a hrají zásadní roli v učení a paměti. Inzulín může také přispět k modulaci neurotransmiterů CNS, zejména acetylcholinu a norepinefrinu, které jsou důležité pro normální poznání a zdraví mozku.,18
Inzulinové Rezistence a Demence
Přehled: zdá se, že mnoho defekty v inzulínové signalizace v mozku AD pacientů, což vede ke snížení využití glukózy a energetického metabolismu.6,19 As T2DM je spojena s periferní inzulínovou rezistencí, AD je spojena s mozkovou inzulinovou rezistencí.20 Brzy v REKLAMĚ, tam se zdá být nedostatečné inzulín příjmu a signalizace v mozku, známky inzulinové rezistence.5,19,21,22 zvýšené inzulínové receptory byly pozorovány v mozku pacientů s AD, pravděpodobně jako kompenzace inzulínové rezistence.,21
celkově má toto zhoršení inzulínové signalizace mnoho následných účinků v AD. Jedna teorie je, že nízké koncentrace inzulínu v CNS způsobují pokles hladin acetylcholinu a průtok krve mozkem.13 změny koncentrací inzulínu mohou navíc podpořit tvorbu beta-amyloidu a tau proteinu.2 v mozku se enzym degradující inzulín (IDE) podílí na degradaci a clearance beta-amyloidních proteinů.21 vysoké hladiny inzulínu inhibují IDE a mohou vést ke snížení clearance beta-amyloidu, následně ke zvýšení depozice beta-amyloidu v mozku.,5,19,21
nedávno ceramidy, rodina lipidů, upoutaly pozornost na svou potenciální roli v inzulínové rezistenci a demenci.23,24 ceramidy jsou generovány v přítomnosti zánětu, který je běžný u obezity, T2DM a AD.24 Protože ceramide snadno prochází přes BBB, expozice způsobuje poruchou energetického metabolismu a změny v inzulínu na genovou expresi, což přispívá k rezistenci na inzulín.23,24 Toto je v současné době aktivní oblast zájmu, přičemž vědci prokázali, že inhibice syntézy ceramidu zabránila inzulínové rezistenci zprostředkované obezitou.,24
intranasální inzulín: jak již bylo zmíněno, podávání intranasálního inzulínu zlepšuje výkonnost paměti u lidí.16 bylo provedeno několik studií intranazálního inzulínu. Po podání 20 jednotek intranazální inzulín dvakrát denně, aby lidské subjekty, Reger et al zjistil, že ve srovnání s placebem, ve skupině léčené inzulínem udržel více verbální informace a ukázal lepší pozornost a funkční stav.,25 Tito výzkumníci také poznamenal, že půstu plazmatické glukózy a inzulínu nezměnila s intranasální použití inzulínu, což naznačuje, že intranazální podávání poskytuje přímý inzulínu přístup k CNS bez periferní účinky.25,26
PPAR-Gamma Agonistů: Rozsáhle studován pro léčbu periferní inzulínovou rezistenci, thiazolidindiony rosiglitazon a pioglitazon jsou vyšetřováni pro jejich úlohu v léčbě AD. Thiazolidindiony jsou peroxizomový proliferátor–aktivovaný receptor (PPAR) – gama agonisté., PPAR-gamma se podílí na metabolismu glukózy a lipidů a moduluje zánět, známý přispěvatel do AD.22,27 thiazolidindiony jsou inzulínové senzibilizátory, které pracují na snížení inzulínové rezistence; zdá se také, že snižují zánět.21,26 v několika placebem kontrolovaných studiích vykazovali pacienti léčení rosiglitazonem zlepšenou paměť a kognitivní funkce.21,22,28 ačkoli byly provedeny pouze malé studie pioglitazonu, tento lék byl také spojen se zlepšením paměti a poznání.,22 přestože pioglitazon a rosiglitazon mají špatnou permeabilitu BBB, každá z těchto látek byla dokumentována v mozku po perorálním podání.22 i když tyto léky mohou hrát roli v prevenci nebo léčbě AD, nejsou v současné době schváleny FDA pro pacienty s AD a jejich potenciální přínosy a rizika, musí být důkladně zváženo individuálně.
aerobní cvičení: možná nejúčinnější a nejvíce přehlížená metoda snižování inzulínové rezistence je fyzická aktivita., Obezita byla spojena se zvýšeným rizikem inzulínové rezistence, diabetu, demence a AD.29,30 cvičení zlepšuje citlivost na inzulín a snižuje periferní hladiny inzulínu.26,31 fyzická aktivita, nezávislá na hmotnosti, je spojena s nižším rizikem AD, což z ní činí jedinou prokázanou neuroprotektivní terapii.29-31 možný mechanismus tohoto neuroprotekce je, že cvičení podporuje clearance beta-amyloidní proteiny a zvyšuje mozku odvozený neurotrofický faktor, růstový faktor životně důležitý pro poznání a neuronální přežití, která je snížena v AD.,32
role lékárníka
lékárníci hrají zásadní roli při výchově pacientů o nových terapiích; musí také držet krok s novými lékařskými objevy nebo stavy, které jsou často prezentovány ve zprávách. Diabetes typu 3 je jedním z takových stavů. I když se o této potenciální nové souvislosti mezi diabetem a zhoršeným poznáním stále mnoho dozví, veřejnost se bude ptát na názor svých poskytovatelů zdravotní péče. Navíc mnoho pacientů s diabetem bude mít zájem dozvědět se více a obrátit se na své lékárníky pro informace., Lékárníci by proto měli se svými pacienty diskutovat o současném chápání tohoto stavu a také jim poradit o strategiích, které mohou vzhledem k jejich individuálním komorbiditám snížit jejich riziko.
závěr
intenzivní studie probíhá ve snaze lépe charakterizovat diabetes typu 3 a vyvinout preventivní a terapeutické strategie. K dnešnímu dni neexistují žádné specifické léčby s prokázanou účinností v prevenci kognitivního poklesu nebo AD u pacientů s DM., Proto, řízení kognitivních funkcí u pacientů s DM je stejná jako u pacientů bez DM, a to se zvláštním důrazem na kontrolu glykémie a kardiovaskulární rizikové faktory. To je stejný přístup, který je již nezbytný pro prevenci komplikací souvisejících s DM. Zatímco některé skupiny pacientů se zdají být vystaveny zvýšenému riziku kognitivního poškození, většina pacientů s DM nemá dobře definované klinické asociace., Ačkoli nejsou k dispozici žádné specifické možnosti léčby, současným logickým přístupem je dosažení glykemické kontroly a obezřetné řízení kardiovaskulárních rizikových faktorů, jako je hyperlipidémie a hypertenze.
1. Stewart R, liolitsa d. diabetes mellitus 2. typu, kognitivní porucha a demence. Diabetická Med.
2. Xu WL, von Strauss E, Qiu CX, et al. Nekontrolovaný diabetes zvyšuje riziko Alzheimerovy choroby: kohortová studie založená na populaci. Diabetologie. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabetes mellitus, demence a kognitivní funkce u starších osob., J Nutr Zdraví Stárnutí. 2006;10:287-291.
4. Jacobson AM, Musen G, Ryan CM, et al. Dlouhodobý účinek diabetu a jeho léčba na kognitivní funkce. N Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. Diabetes typu 2 a riziko kognitivního poškození a demence. Curr Neurol Neurosci Rep. 2007; 7: 373-380.
6. Steen e, Terry BM, Rivera EJ, et al. Porucha exprese inzulínového a inzulínového růstového faktoru a signalizační mechanismy u Alzheimerovy choroby – je tento diabetes typu 3? J Alzheimers Dis. 2005;7:63-80.
7. Americká Diabetická Asociace. Standardy lékařské péče při cukrovce—2010., Péče O Cukrovku.
8. Triplitt Cl, Reasner CA, Isley WL. Diabetes mellitus. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Principy farmakoterapie & praxe. 7.ed. New York, NY: McGraw Hill Medical; 2008:1205-1241.
9. Nathan DM, Buse JB, Davidson MD, et al. Při léčbě hyperglykémie v typu 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: konsensus prohlášení Americké diabetické Asociace a Evropské Asociace pro Studium Diabetu. Péče O Cukrovku.
10. Hebert LE, Scherr PA, Bienias JL, et al., Alzheimerova choroba v americké populaci: odhady prevalence pomocí sčítání lidu v roce 2000. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. Alzheimerova choroba. N Engl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill AM. Alzheimerova choroba. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Principy farmakoterapie & praxe. 7.ed. New York, NY: McGraw Hill Medical; 2008: 1051-1065.
13. Craft S, Watson GS. Inzulín a neurodegenerativní onemocnění: sdílené a specifické mechanismy. Lancet Neurol. 2004;3:169-178.
14. de La Monte SM, hůlky JR., Recenze inzulinu a inzulín-jako růstový faktor exprese, signalizace a poruchy v centrálním nervovém systému: vztah k Alzheimerově nemoci. J Alzheimers Dis. 2005;7:45-61.
15. Park CR, Seeley RJ, Craft S, Woods SC. Intracerebroventrikulární inzulín zvyšuje paměť v úkolu pasivního vyhýbání se. Fyziolog. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et al. Manipulace s neuropeptidergickými cestami u lidí: nový přístup k neurofarmakologii? Eur J Pharmacol. 2000;405:43-54.
17. Čao WQ, Alkon DL. Úloha inzulínového a inzulínového receptoru v učení a paměti., Mol Cell Endocrinol. 2001;177:125-134.
18. Kopf s, Baratti C. účinky posttrainingového podávání inzulínu na retenci habituační odpovědi u myší: účast centrálního cholinergního mechanismu. Neurobiol Učit Mem.
19. Revill P, morální MA, Prous JR. zhoršená signalizace inzulínu a patogeneze Alzheimerovy choroby. Drogy Dnes (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Longato L, et al. Omezená neurodegenerace Alzheimerova typu u experimentální obezity a diabetes mellitus 2.typu. J Alzheimers Dis. 2008;15:29-44.
21. Haan MN., Terapie insight: diabetes mellitus 2. typu a riziko Alzheimerovy choroby s pozdním nástupem. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar S, et al. PPARgamma agonisté jako terapeutika pro léčbu Alzheimerovy choroby. Neurotherapeutika. 2008;5:481-489.
23. Lyn-Cook LE, Lawton M, Tong M, et al. Jaterní ceramid může zprostředkovat mozkovou inzulinovou rezistenci a neurodegeneraci u diabetu 2.typu a nealkoholické steatohepatitidy. J Alzheimers Dis.
24. Tong M, de La Monte SM. Mechanismy neurodegenerace zprostředkované ceramidem. J Alzheimers Dis.
25., Reger MA, Watson GS, Green PS. Intranasální inzulín zlepšuje poznání a moduluje beta-amyloid na počátku AD. Neurologie. 2008;70:440-448.
26. Craft s. syndrom inzulínové rezistence a Alzheimerova choroba: účinky související s věkem a obezitou na paměť, amyloid a zánět. Neurobiol Stárnutí. 2005; 26 (suppl 1):65-69.
27. Jiang Q, Heneka M, Landreth GE. Úloha peroxisomového proliferátoru-aktivovaného receptoru-gama (PPARgamma) u Alzheimerovy choroby: terapeutické důsledky. CNS drogy. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, et al., Zachované poznání u pacientů s časnou Alzheimerovou chorobou a amnestickou mírnou kognitivní poruchou během léčby rosiglitazonem: předběžná studie. Am J Geriatr Psychiatrie. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. adipozita a Alzheimerova choroba. Curr Alzheimer Res. 2007; 4: 127-134.
30. Whitmer RA. Epidemiologie adipozity a demence. Curr Alzheimer Res. 2007; 4: 117-122.
31. Watson GS, Craft s. role inzulínové rezistence v patogenezi Alzheimerovy choroby: důsledky pro léčbu. CNS drogy. 2003;17:27-45.
32. Cole GM, Frautschy SA., Úloha signalizace inzulínu a neurotrofického faktoru při stárnutí mozku a Alzheimerově chorobě. Exp Gerontol. 2007;42:10-21.
















Napsat komentář