přemýšlejte o tom, co se stane v polovině cesty změnou barvy. V tomto okamžiku jsou koncentrace kyseliny a jejího iontu stejné. V takovém případě se zruší z laskavého výrazu.
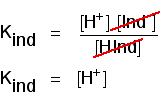
můžete použít zjistit, jaké pH je v této půli cesty., Pokud jste re-uspořádat poslední rovnice tak, že koncentrace vodíkových iontů je na levé straně, a pak převést na pH a pKind, dostanete:
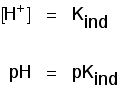
to znamená, Že koncový bod na indikátoru závisí zcela na tom, co jeho pKind hodnota je. Pro ukazatele jsme viděli výše, tyto jsou:
| ukazatel | pKind |
|---|---|
| lakmusový | 6.5 |
| methyl-oranžová | 3.7 |
| fenolftalein | 9.,3 |
rozsah pH indikátorů
indikátory nemění barvu ostře při jednom konkrétním pH(dané jejich pKind). Místo toho se mění v úzkém rozsahu pH.
předpokládejme, že rovnováha je pevně na jedné straně, ale nyní přidáte něco, co ji začne posouvat. Jak se rovnováha posouvá, začnete získávat stále více druhé barvy a v určitém okamžiku ji oko začne detekovat.
Předpokládejme například, že jste měli methyl oranžový v alkalickém roztoku, takže dominantní barva byla žlutá., Nyní začněte přidávat kyselinu tak, aby se rovnováha začala posouvat.
V určitém okamžiku tam bude dost červená forma methyloranže představit, že řešení bude začít, aby se na oranžový odstín. Jak budete pokračovat v přidávání více kyseliny, červená se nakonec stane tak dominantní,že nemůžete longe vidět žádnou žlutou.
Tam je postupný hladký přechod z jedné barvy do druhé, odehrávající se v rozsahu pH. Jako hrubý „pravidlo“, viditelná změna se odehrává o 1 jednotku pH obou stranách pKind hodnotu.,
přesné hodnoty pro tři ukazatele, podívali jsme se na:
| ukazatel | pKind | pH rozpětí |
|---|---|---|
| lakmusový | 6.5 | 5 – 8 |
| methyl-oranžová | 3.7 | 3.1 – 4.4 |
| fenolftalein | 9.3 | 8.3 – 10.0 |
lakmusový barevná změna se stane přes neobvykle širokém rozsahu, ale to je užitečné pro detekci kyselin a zásad v laboratoři, protože to mění barvu kolem pH 7., Methyl oranžový nebo fenolftalein by byl méně užitečný.
to je snadněji vidět diagramaticky.
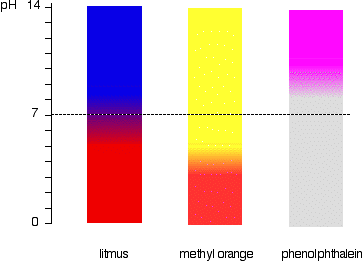
například methyl Oranžová by byla žlutá v jakémkoli roztoku s pH větším než 4.4. Nemohla rozlišovat mezi slabou kyselinou s pH 5 nebo silnou alkálií s pH 14.
Volbu indikátory pro titrace
Pamatujte si, že ekvivalence bod titrace je místo, kde můžete mít smíšené dvou látek v přesně rovnice rozměrů., Je zřejmé, že je třeba zvolit indikátor, který změní barvu co nejblíže k tomuto bodu ekvivalence. To se liší od titrace k titraci.
silná kyselina v silná báze
následující diagram ukazuje křivku pH pro přidání silné kyseliny do silné báze. Překrývají se na něm rozsahy pH pro methyl oranžový a fenolftalein.
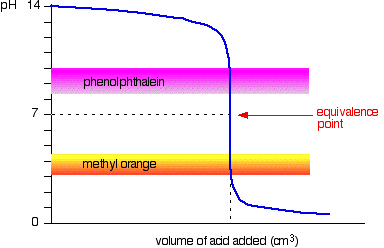
můžete vidět, že ani jeden indikátor nezmění barvu v bodě ekvivalence.,
graf je však v tomto bodě tak strmý, že v objemu přidané kyseliny nebude prakticky žádný rozdíl podle toho, který indikátor zvolíte. Mělo by však smysl titrovat s každým indikátorem nejlepší možnou barvu.
Pokud používáte fenolftalein, titrujte jej, dokud nebude bezbarvý (při pH 8.3), protože to je tak blízko, jak se můžete dostat k bodu ekvivalence.
na druhé straně pomocí methylově oranžové byste titrovali, dokud nebude v roztoku úplně první stopa pomeranče., Pokud se roztok zčervená, dostanete se dále od bodu ekvivalence.
Silná kyselina, v slabá báze,
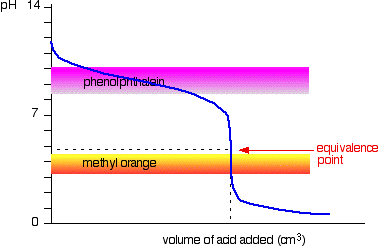
Tento čas je zřejmé, že fenolftalein by bylo zcela zbytečné. Methyl orange se však začíná měnit ze žluté na oranžovou velmi blízko bodu ekvivalence.
musíte zvolit indikátor, který změní barvu na strmém kousku křivky.
slabá kyselina v silná báze
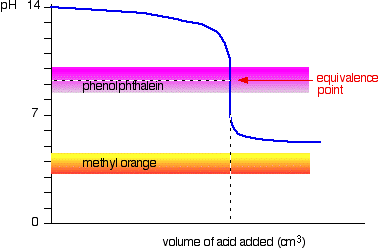
tentokrát je methyl oranžová beznadějná!, Fenolftalein však mění barvu přesně tam, kam chcete.
Slabé kyseliny v. slabá báze,
křivka je pro případ, kdy kyseliny a báze jsou stejně slabé – například, ethanoic kyseliny a roztoku amoniaku. V ostatních případech, rovnovážný bod bude na nějaké jiné pH.
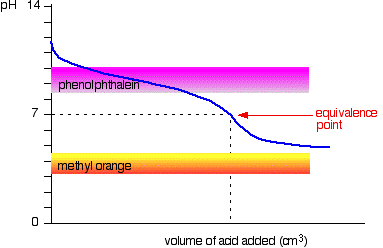
můžete vidět, že ani ukazatel je k ničemu. Fenolftalein se bude před bodem ekvivalence dobře měnit a methyl orange úplně spadne z grafu.,
To může být možné najít indikátor, který začne měnit nebo povrchové úpravy mění na rovnovážný bod, ale proto, pH bod ekvivalence se bude lišit případ od případu, nemůžete zobecňovat.
celkově byste nikdy titrovali slabou kyselinu a slabou základnu za přítomnosti indikátoru.
roztok uhličitanu sodného a zředěná kyselina chlorovodíková
toto je zajímavý zvláštní případ., Pokud používáte fenolftalein nebo methyloranž, jak se bude dát platný titrace výsledek – ale hodnota s fenolftalein bude přesně polovina methyl oranžovou.
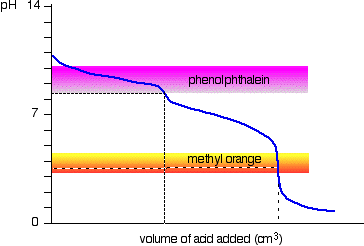
stává se tak, že fenolftalein dokončil svou změnu barvy přesně v bodě pH ekvivalence první poloviny reakce, ve které se vyrábí hydrogenuhličitan sodný.
![]()
![]()
methyl orange mění barvu přesně v pH rovnovážný bod druhé fázi reakce.,
![]()
![]()
Otázky otestovat své znalosti
Pokud je to první sada otázek jste udělal, prosím, přečtěte si úvodní stránku, než začnete. Budete muset použít tlačítko zpět v prohlížeči, abyste se sem vrátili.
otázky týkající se ukazatelů
odpovědi
kam byste chtěli jít teď?
do acidobazické rovnováhy . . .
do nabídky fyzikální chemie . . .
do hlavní nabídky . . .,
















Napsat komentář