| Universidade de Sheffield | |
| Departamento de Química | VSEPR |
A amônia também tem quatro pares de elétrons e a coordenação de geometria de nitrogênio é baseado em um arranjo tetraédrico de pares de elétrons. Existem apenas três grupos ligados, portanto há um único par. No entanto, uma vez que os pares solitários são “invisíveis”, a forma de amônia é piramidal.,r>
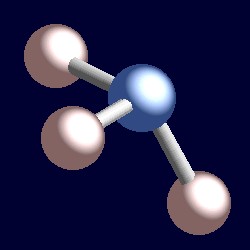
considere um par de elétrons de ligação. Os dois elétrons estão localizados entre dois núcleos, e são atraídos por ambos. Um par solitário é diferente. Ela é necessariamente atraída apenas para um núcleo e a consequência é que ela adota uma posição efetivamente mais próxima desse núcleo do que os pares de ligações de elétrons. Isto significa que o ângulo sólido efetivo ocupado por um par solitário é maior do que o ocupado por um par de ligações., Os pares solitários exigem maior espaço angular, e estão localizados mais perto de seus átomos do que pares de ligações. A consequência disto para amônia é que o par solitário faz espaço para si mesmo, empurrando os três átomos de hidrogênio juntos um pouco e os ângulos de ligação H-N-H são ligeiramente menos (106,6°) do que o ângulo tetraédrico ideal de 109,5°.
















Deixe uma resposta