pense no que acontece a meio da mudança de cor. Neste ponto as concentrações do ácido e seu íon são iguais. Nesse caso, eles vão cancelar a expressão gentil.
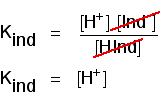
Você pode usar isso para descobrir qual é o pH neste ponto de meio caminho., Se você reorganizar a última equação, de modo que a concentração do íon de hidrogênio é no lado esquerdo e, em seguida, converter para pH e pKind, você obtém:
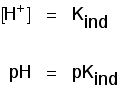
o que significa Que o ponto final para o indicador depende inteiramente o que a sua pKind é o valor. Para os indicadores vimos acima, estes são:
| indicador | pKind |
|---|---|
| principal | 6.5 |
| metil orange | 3.7 |
| fenolftaleína | 9.,3 |
a gama de indicadores do pH
ndicadores não mudam acentuadamente de cor a um determinado pH (dado pelo seu tipo). Em vez disso, eles mudam sobre uma estreita faixa de pH.
Assume que o equilíbrio é firmemente para um lado, mas agora você adiciona algo para começar a mudá-lo. À medida que o equilíbrio muda, você vai começar a obter mais e mais da segunda cor formada, e em algum momento o olho vai começar a detectá-lo.por exemplo, suponha que tinha laranja-metilo numa solução alcalina, de modo que a cor dominante era amarela., Agora começa a adicionar ácido para que o equilíbrio comece a mudar.
em algum momento haverá o suficiente da forma vermelha da laranja-metilo presente para que a solução comece a tomar uma tonalidade laranja. À medida que você continuar adicionando mais ácido, o vermelho acabará por se tornar tão dominante que você não pode esperar ver qualquer amarelo.
há uma mudança gradual suave de uma cor para a outra, ocorrendo ao longo de um intervalo de pH. como uma “regra de polegar” áspera, a mudança visível ocorre cerca de 1 unidade de pH de cada lado do valor de pKind.,
Os valores exatos para os três indicadores de nós olhamos são:
| indicador | pKind | faixa de pH |
|---|---|---|
| principal | 6.5 | 5 – 8 |
| metil orange | 3.7 | 3.1 – 4.4 |
| fenolftaleína | 9.3 | 8.3 – 10.0 |
O indicador de mudança de cor acontece através de uma invulgarmente grande variedade, mas é útil para a detecção de ácidos e álcalis, no laboratório, porque ele muda de cor em torno de pH 7., Laranja-metilo ou fenolftaleína seria menos útil.
isto é mais facilmente visto diagramaticamente.
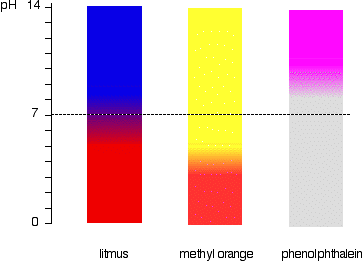
por exemplo, o laranja-metilo seria amarelo em qualquer solução com um pH superior a 4.4. Não conseguia distinguir entre um ácido fraco com um pH de 5 ou um alcalino forte com um pH de 14.
escolhendo indicadores para titulações
lembre-se que o ponto de equivalência de uma titulação é onde você misturou as duas substâncias em proporções de equação exactas., É óbvio que é necessário escolher um indicador que mude de cor o mais próximo possível desse ponto de equivalência. Isso varia de titulação a titulação.o diagrama seguinte mostra a curva de pH para adicionar um ácido forte a uma base forte. Sobre ele estão sobrepostas as gamas de pH para laranja-metilo e fenolftaleína.
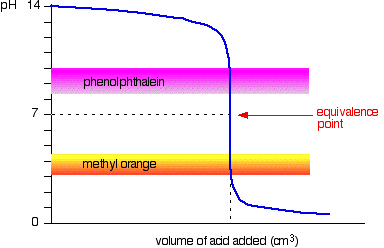
pode ver que nenhum dos indicadores muda de cor no ponto de equivalência.,
no entanto, o gráfico é tão íngreme nesse ponto que não haverá praticamente nenhuma diferença no volume de ácido adicionado qualquer que seja o indicador que você escolher. No entanto, faria sentido titular da melhor cor possível com cada indicador.se utilizar fenolftaleína, titular até se tornar incolor (a pH 8, 3) porque é o mais próximo possível do ponto de equivalência.por outro lado, usando laranja-metilo, titular até que haja o primeiro vestígio de laranja na solução., Se a solução ficar vermelha, você está ficando mais longe do ponto de equivalência.
Strong acid v weak base
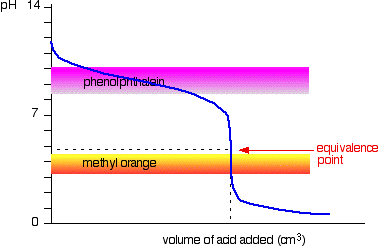
desta vez é óbvio que a fenolftaleína seria completamente inútil. No entanto, o laranja-metilo começa a mudar de amarelo para laranja muito próximo do ponto de equivalência.
Você tem que escolher um indicador que muda de cor no íngreme pedaço da curva.
Weak acid v strong base
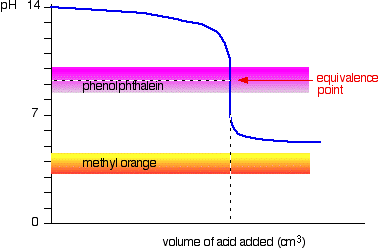
desta vez, a laranja-metilo é inútil!, No entanto, a fenolftaleína muda de cor exatamente onde você quer.
Weak acid v weak base
a curva é para um caso em que o ácido e a base são igualmente fracos – por exemplo, ácido etanóico e Solução de amônia. Em outros casos, o ponto de equivalência será em algum outro pH.
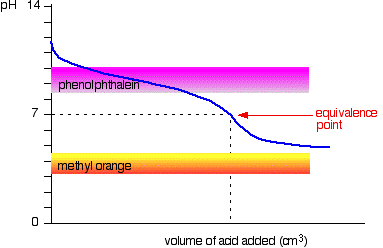
Você pode ver que nem indicador é qualquer uso. Fenolftaleína terá acabado de mudar bem antes do ponto de equivalência, e laranja-metilo cai completamente do grafo.,
pode ser possível encontrar um indicador que começa a mudar ou termina mudando no ponto de equivalência, mas como o pH do ponto de equivalência será diferente de caso para caso, você não pode generalizar.em geral, nunca se titula um ácido fraco e uma base fraca na presença de um indicador.
solução de carbonato de sódio e ácido clorídrico diluído
Este é um caso especial interessante., Se utilizar fenolftaleína ou laranja-metilo, ambos darão um resultado de titulação válido – mas o valor com fenolftaleína será exactamente metade do laranja-metilo.
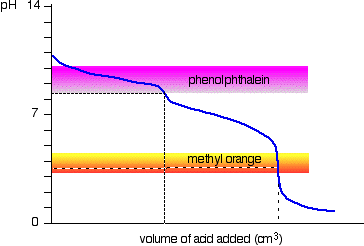
acontece que a fenolftaleína terminou a sua mudança de cor exatamente o pH do ponto de equivalência da primeira metade da reação em que o sódio hydrogencarbonate é produzido.
![]()
![]()
a laranja metilo muda de cor exactamente ao pH do ponto de equivalência da segunda fase da reacção.,
![]()
![]()
Perguntas para testar o seu conhecimento
Se este é o primeiro conjunto de perguntas que você tem feito, por favor, leia a página de introdução antes de começar. Você vai precisar usar o botão de trás no seu navegador para voltar aqui depois.
questions on indicators
answers
onde você gostaria de ir agora?no menu de equilíbrio ácido-base . . .
no menu de Química Física . . .
para o Menu principal . . .,
















Deixe uma resposta