Introdução
os Cloroplastos representam uma característica estrutural das células vegetais e suporte de sobrevivência da planta através de seu principal metabolismo e funções de alto nível (Kirk e Tilney-Bassett, 1978; Tainha, 1988; López-Juez e Pyke, 2005). Durante o crescimento vegetativo vegetal, as células das folhas contêm uma população altamente homogênea de cloroplastos em relação ao tamanho e forma., O número de cloroplastos por célula é alcançado pela fissão binária de organelas pré-existentes e particionamento em duas células filhas durante a divisão celular (Birky, 1983; Possingham e Lawrence, 1983). Assim, a regulação do número de cloroplastos em um determinado tipo de célula é crucial para a função celular e herança genética dos cloroplastos.
to investigate the nature of chloroplast number determination in plant cells, leaf mesophyll cells of representative species have played a major role ., Estas células são fisiologicamente importantes para a fotossíntese e mostram um elevado grau de homogeneidade estrutural e funcional. Análises de observação sistemática precoce de tecidos e células isolados (Boasson e Laetsch, 1969; Possingham e Saurer, 1969; Boffey et al., 1979; Lambpa et al.,, 1980; Thomas e Rose, 1983; Pyke e Leech, 1991) forneceu muita informação útil sobre chloroplast número de determinação, incluindo a noção de que os cloroplastos (plastids) não são sintetizados de novo, mas replicar a divisão e a observação de que a folha mesophyll chloroplast número é sensível a várias ambiental e planta-factores endógenos. No que diz respeito a este último, em espinafres, a luz tem um impacto positivo na Divisão de cloroplastos durante a cultura do disco em folha em comparação com condições dim ou dark (Possingham e Lawrence, 1983)., Nas primeiras folhas de trigo, o volume celular está positivamente correlacionado com a proliferação de cloroplastos (Ellis e Leech, 1985; Pyke e Leech, 1987). Em Arabidopsis, o fundo genético afeta a proliferação de cloroplastos; o número médio de cloroplastos por célula nas primeiras folhas é de 121 no ecótipo Landsberg erecta (Ler) e 83 no ecótipo Wassilewskija (Ws) (Pyke e Leech, 1994; Pyke et al., 1994)., Células de mesofila-folha também contribuíram para a compreensão do controle genético da Divisão de cloroplastos; por exemplo, mutantes de triagem prejudicados na proliferação de cloroplastos e caracterizando funções genéticas envolvidas na Divisão de cloroplastos revelaram mais de 20 genes que codificam componentes de máquinas da Divisão de cloroplastos ou fatores reguladores de cloroplastos (Gao e Gao, 2011; Miyagishima et al., 2011; Basak and Møller, 2013; Osteryoung and Pyke, 2014; Li et al., 2017).por outro lado, estudos sobre a replicação de cloroplastos em células não mesofilas (ex.,, Pavement cells in leaf epidermis; Itoh et al., 2018) são escassos. Recentemente, a regulação da divisão do cloroplasto tem sido relatada diferindo entre os tecidos de folha (Fujiwara et al., 2018; Itoh et al., 2018), embora o mecanismo detalhado permanece desconhecido. Além disso, enquanto as análises de células BY-2 cultivadas em suspensão e protoplastos mesofílicos de folhas em tabaco e atirar meristem apical e células primordiais de folhas em Arabidopsis (Nebenführ et al., 2000; Sheahan et al.,, 2004; Seguí-Simarro and Staehelin, 2009) have provided major insights, how chloroplast (plastid) particioning is regulated in plants is still unclear. Assim, apesar de um esforço considerável, permanecem questões fundamentais na pesquisa de cloroplastos, como (i) como é o número de cloroplastos por célula coordenado em tecidos vegetais e (ii) como é o particionamento de cloroplastos regulado na divisão celular.,
History of Research on Guard Cell Chloroplast Number
Stomatal GCs in the shoot epidermis generally contain chloroplasts and control gas exchange between the leaf mesophyll and the atmosphere (Sachs, 1875; Taiz et al., 2015; ver Figura 1A). A primeira investigação do número de cloroplastos GC em folhas foi realizada há mais de um século em plantas de Drosera naturalmente cultivadas (Macfarlane, 1898)., Este estudo demonstrou que, assim como outras plantas e células de características estruturais, GC chloroplast número por célula em um suposto híbrido derivado a partir de um cruzamento entre Drosera filiformis e Drosera intermedia foi intermediário entre as duas espécies, o que implica que o GC chloroplast número pode ser usado para determinar a composição genética de uma planta. Observações importantes foram posteriormente relatadas sobre as diferenças no número de cloroplastos GC entre as espécies vegetais (Sakisaka, 1929) e o número relativamente estável de cloroplastos em GCs na epiderme de folhas da amora (Morus spp.,; Hamada and Baba, 1930) and in mature leaves of several Brassica species (Iura, 1934). Além disso, a análise das plantas de beterraba sacarina autopoliplóide (Beta vulgaris) revelou que o número de cloroplastos GC nas folhas está positivamente correlacionado com o nível de ploidia nuclear das plantas (Mochizuki e Sueoka, 1955). Análises mais aprofundadas e abrangentes foram então realizadas usando várias amostras de plantas para investigar a relação entre o número de cloroplastos e o tamanho estomatal com o nível de ploidia (por exemplo, Frandsen, 1968)., Nestas análises, chloroplast de contagem, no stomatal (GC par) nível era frequentemente adotada, o que excluiu o efeito de parcialidade chloroplast distribuição entre emparelhado GCs (por exemplo, Mochizuki e Sueoka, 1955; Frandsen, 1968), revelando que a média do GC chloroplast número de folhas e cotilédones em cerca de 80 espécies, variantes, ou híbridos variou de 2,8 a 40,0 em diplóides (2×) e 5.0 para 73,5 no tetraploids (4×). Além disso, eventos de duplicação do genoma total nas plantas (ou seja, 1× a 2×, 2× a 4×, etc.) causou cerca de 1.,Aumento de 7 vezes no número de cloroplastos GC com alta fidelidade (revisado em Butterfass, 1973). Estes resultados incentivaram investigações em nível de ploidia em vários tecidos e plantas obtidas através de cultura de tecidos, travessia ou naturais de cultivo, em combinação com produtos químicos (por exemplo, colchicina) ou tratamentos de radiação (por exemplo, Jacobs e Yoder, 1989; Singsit e Veilleux, 1991; Qin e Rotino, 1995)., Enquanto o GC chloroplast número tem sido estudada em stomatal biologia (Lawson, 2009) e citologia para entender chloroplast multiplicação (Butterfass, 1979; veja abaixo), foi amplamente servido como um confiável e conveniente marcador para a detecção de híbridos, espécies e variantes e para a estimativa de níveis de ploidia de destino tecidos da planta.
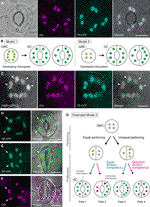
Figura 1 modelos simplificados e provas microscópicas para o controlo do número de cloroplastos nas células de guarda estomatal (SCG)., A) um estoma típico (par de GC) na epiderme abaxial da lâmina Arabidopsis que exprime uma fusão do péptido de trânsito (TP) com a proteína fluorescente ciano (PFR; TP-PFR) orientada para o estoma. B) dois modelos de determinação do número de cloroplastos em GCs, envolvendo a separação do cloroplasto (modelo 1) ou a proliferação e separação do cloroplasto (modelo 2) durante o desenvolvimento do GC a partir de células-mãe de guarda (GMCs). C) um par de GC na epiderme adaxial do petiolo de folhas Arabidopsis que exprime o TP-PFR e o FtsZ1 fundidos à proteína verde fluorescente (GFP; FtsZ1-GFP)., (D–F) pares de GC em epidermes abaxiais de folhas de Arabidopsis com (D, e) ou sem (F) a expressão de TP fundida à proteína fluorescente amarela (YFP; TP-YFP). F) A Auto-fluorescência da clorofila (LCH) foi utilizada como marcador de cloroplastos., G) Modelo 2 alargado, que representa o envolvimento de uma separação igual e desigual dos cloroplastos após a divisão GMC e subsequente divisão dos cloroplastos GC com competência de divisão igual (linha azul) ou selectiva (linha vermelha), o que resultaria em quatro tipos de determinação do número de cloroplastos (destinos 1-4) durante o desenvolvimento estomatal tardio das folhas de Arabidopsis. (A, C–F) a microscopia de Epifluorescência foi realizada com um microscópio invertido IX71 do Olimpo utilizando materiais vegetais como descrito anteriormente (Fujiwara et al., 2017, Fujiwara et al., 2018)., Sinais fluorescentes de clorofila, PFR, GFP e YFP São pseudo-coloridos em magenta, Ciano, Verde (apenas na imagem mesclada) e verde, respectivamente. As indicações nos painéis são as seguintes: ponta de flecha, o anel FtsZ1; seta, cloroplasto GC aumentado; linha tracejada, forma celular. Barra de escala = 10 µm.
Utility of Leaf Guard Cells For the Analysis Of Chloroplast Number Control
Leaf mesophyll cells have been employed as a primary model for the analysis of chloroplast number., Embora eles tenham vantagens para o estudo dos efeitos das condições ambientais na Divisão de cloroplastos (por exemplo, a sinalização da citoquinina leve; Boasson e Laetsch, 1969; Possingham e Lawrence, 1983; Okazaki et al., 2009; Chiang et al., 2012), são limitados em alguns aspectos. Em primeiro lugar, as células mesofilas das folhas variam em tamanho e forma e são distribuídas profundamente dentro da folha, o que torna difícil manipular tecidos intactos., Em segundo lugar, a susceptibilidade da proliferação de cloroplastos mesofílicos das folhas ao stress ambiental e às condições de crescimento das plantas pode impedir comparações fiáveis entre estudos. O número de cloroplastos de mesophyll por célula no ecótipo Arabidopsis Columbia (Col) tem sido relatado variadamente como 76 (Kinsman e Pyke, 1998), 80-100 (Stokes et al., 2000), 70 (Tirlapur and König, 2001), 41 (Yoder et al., 2007), 40-60 (Okazaki et al., 2009), e 30-40 (Kawade et al., 2013)., Além disso, é quase impossível avaliar a contribuição do particionamento de cloroplastos para o número final de cloroplastos por célula mesofílica durante o desenvolvimento das folhas, embora se pense que isso seja determinado pelo equilíbrio entre a taxa de divisão celular e a taxa de divisão de cloroplastos. Para descobrir o mecanismo de controle do número de cloroplastos em células de folhas vegetativas, é necessário um sistema modelo que supere as questões acima.os GCs Estomatais (ver Figura 1A) apresentam as características de um sistema modelo para a compreensão do mecanismo de controlo do número de cloroplastos., Os GCs são altamente uniformes em tamanho e forma dentro de um tecido, e sua distribuição dispersa, mas densa, na camada externa de rebentos facilita a sua detecção por microscopia de luz e fluorescência. GCs são também derivados da protodermal células na atirar apical meristem ou embrionárias a partir de células epidérmicas, e sua sequência de desenvolvimento através de meristemoids (um stomatal precursor com meristemático atividade) e guarda mãe células (GMCs; um precursor do GC pares) é estabelecida em detalhe (Zhao e Saco, 1999; Nadeau e Saco, 2002; Kalve et al., 2014)., O desenvolvimento estomatal tardio envolve uma única rodada de divisão simétrica GMC, que permite a avaliação da distribuição de cloroplastos e particionamento antes e depois da citocinese. Do ponto de vista das experiências práticas, os GCs das folhas são adequados para microscopia. Foi mostrado anteriormente que o número de cloroplastos por célula em Glcs de folha de Sinapis alba foi menos afetado por diferentes condições de luz do que nas células de mesofila das folhas (Selvagem e lobo, 1980)., Além disso, a diferença no número de cloroplastos GC nos petíolos folha é relativamente menor entre os três Ecotipos Arabidopsis Col, Ler e Ws (Fujiwara et al., 2018). Além disso, a endoreduplicação, que tem impacto no desenvolvimento de células mesofílias, pavimentos e trichome, não foi detectada no Arabidopsis leaf GCs (Melaragno et al., 1993), que garantiria as interpretações dos dados do número de cloroplastos ao nível 2C das células., Juntos, estes relatórios sugerem que GCs de folha são potencialmente um excelente modelo para a análise sistemática da dinâmica do número de cloroplastos em uma linhagem celular particular.
Arabidopsis Folha de Guarda de Células como um Modelo para o Estudo do Controle de Chloroplast Número
Na história do GC chloroplast pesquisa, chloroplast de contagem, no stomatal (GC par) nível tem servido igualmente um papel importante na determinação da chloroplast número de contagem, em cada nível GC. Ambos os métodos produzem o mesmo número médio de cloroplastos (Butterfass, 1973)., Quando a variação na distribuição de cloroplastos em GCs emparelhados e seu mecanismo subjacente é um assunto de foco, informações detalhadas de cloroplastos ao nível celular individual, ou seja, seu tamanho, forma e localização intracelular, é essencial. A proliferação de cloroplastos (plastid) durante a diferenciação GMC–GC foi previamente investigada em várias espécies vegetais (Butterfass, 1973, Butterfass 1979)., Estes estudos propuseram dois modelos para determinar o número terminal de cloroplastos em GCs em diferentes espécies vegetais (figura 1B): um (modelo 1; beterraba sacarina) envolve apenas a separação de cloroplastos na divisão GMC, e o outro envolve não só a separação de cloroplastos, mas também a proliferação de cloroplastos durante o desenvolvimento de GC.
na era da Genética molecular, genómica, imagiologia celular e outras análises interdisciplinares, existem muitas possibilidades para a caracterização adicional do mecanismo de particionamento do cloroplasto., Arabidopsis leaf GCs may be one of the best model systems for this purpose. Vários estudos examinaram o número de cloroplastos GC nas folhas ou cotilédones de Arabidopsis (Hoffmann, 1968; Pyke and Leech, 1994; Pyke et al., 1994; Robertson et al., 1995; Keech et al., 2007; Chen et al., 2009; Yu et al., 2009; Higaki et al., 2012; Fujiwara et al., 2018). Estes GCs apresentam um número modesto de cloroplastos, variando de 3,5 a 5,5 em média. Até à data, nenhum estudo examinou as alterações no número de cloroplastos (plastídeos) durante o desenvolvimento estomatal., No entanto, evidências microscópicas de análises de desenvolvimento estomatal (por exemplo, Zhao e Sack, 1999; Hachez et al., 2011) e nossas observações preliminares indicam que os GMCs podem conter um número menor de cloroplastos em desenvolvimento do que os GCs e que a proliferação de cloroplastos pode ocorrer durante a diferenciação GC. Para testar isso, a formação da maquinaria da Divisão de cloroplastos no GCs foi monitorada com a sonda FtsZ1 fundida à proteína verde fluorescente (FtsZ1-GFP) (Fujiwara et al., 2008)., Uma linha transgênica, expressando simultaneamente um peptídeo de trânsito (TP) fundido PFR e FtsZ1-GFP para visualizar o estroma e o anel FtsZ1, respectivamente, foi examinada por microscopia de epifluorescência (Fujiwara et al., 2017). Foram empregados petíolos de folha em expansão (quinta folhas de mudas com 4 semanas de idade). Como resultado, foram detectados GCs com cloroplastos simetricamente constritores (figura 1C). Estes cloroplastos formaram o anel FtsZ1, um anel de divisão de cloroplastos na superfície estromal da membrana interna do envelope em folhas mesofílas e células de pavimento (Vitha et al., 2001; Fujiwara et al.,, 2008), no local de constrição equatorial. Consistente com o padrão estomatal no desenvolvimento de folhas Arabidopsis (Donnelly et al., 1999; Andriankaja et al., 2012), os cloroplastos divisores foram detectados no final, bem como no início, da fase de expansão das folhas. Assim, o modelo 2 é provavelmente o melhor ajuste para o Arabidopsis leaf GCs.
relação entre proliferação de cloroplastos e expansão em células de guarda de folhas de Arabidopsis
além disso, foi observado um fenótipo inesperado da morfogénese de cloroplastos de GC em GCs maduros (figuras 1D, e)., Quando as cascas epidérmicas de folhas totalmente expandidas (lâminas da terceira folha de 4 semanas) de uma linha TP–fundida de proteína fluorescente amarela (YFP) foram microscopicamente caracterizadas (linha FL6-5; Fujiwara et al., 2018), alguns estomas mostraram padrões desiguais de distribuição de cloroplastos em pares de GC, enquanto a maioria dos estomas de folhas mostravam padrões iguais ou similares de distribuição de cloroplastos (Robertson et al., 1995; Fujiwara et al., 2018)., Dentro do par GC de um estoma, o tamanho dos cloroplastos no GC contendo menor número de cloroplastos era maior do que nos outros GCs do par contendo maior número de cloroplastos (figuras 1D, E). Desta forma, os GCs provavelmente mantêm o volume total de cloroplastos por célula a um nível constante durante o crescimento celular. Cloroplastos ampliados representavam o fenótipo terminal e não podiam mais dividir-se em folhas expandidas. Estes resultados foram confirmados em vários experimentos independentes, independentemente da expressão de uma proteína fluorescente fundida com TP para a rotulagem de estroma (figura 1F).,
Este fenótipo de cloroplastos GC é interpretado como um mecanismo de compensação para a expansão de cloroplastos, que foi bem documentado em células de mesofila de folhas defeituosas no controle da Divisão de cloroplastos (Pyke e Leech, 1994; Pyke et al., 1994). Até à data, apenas um estudo (Ellis e Sanguessuga, 1985) apresentou uma correlação negativa entre chloroplast número e chloroplast tamanho em folha mesophyll células de trigo, considerando que muitos estudos relataram uma correlação positiva entre o volume da célula e chloroplast número normal de folha mesophyll células (Sanguessuga e Pyke, 1988; Pyke, 1997)., Enquanto que os desequilíbrios no número de cloroplastos GC ocorrem com baixa frequência (Fujiwara et al., 2018), a heterogeneidade dos cloroplastos em pares de GC indica que uma separação desigual dos cloroplastos poderia desencadear um crescimento diferencial dos cloroplastos entre as células de folhas selvagens em Arabidopsis, apesar da divisão celular simétrica.o efeito de compensação dos cloroplastos no GCs pode ser menos rigoroso do que nas células de mesofila das folhas., GCs pode ser capaz de resistir a escassez ou perda completa do total de chloroplast volume por célula na gravemente prejudicada chloroplast divisão de mutantes, como em Arabidopsis, arc6 e atminE1 e tomate suffulta, considerando que muitos mutante Gc apresentaram menor chloroplast número e ampliada chloroplast tamanho do mesmo modo para a folha mesophyll células (Robertson et al., 1995; Forth and Pyke, 2006; Chen et al., 2009; Fujiwara et al., 2018)., In a late chloroplast division mutant, arc5, the reduction in GC chloroplast number was not associated with a significant increase in chloroplast size, unlike in leaf mesophyll cells (Pyke and Leech, 1994). A lower degree of chloroplast expansion in GCs than in mesophyll cells (Pyke and Leech, 1994; Barton et al., 2016), e a variação na expansão de cloroplastos entre GCs, pode estar subjacente a uma tão ampla gama admissível de volume total de cloroplastos por GC., Além disso, o momento da Divisão de cloroplastos durante a diferenciação GMC–GC pode afectar significativamente o fenótipo terminal de cloroplastos GC. Embora seja necessária uma caracterização mais detalhada para abordar esta questão, parece plausível que a Arabidopsis leaf GCs represente um sistema para investigar os aspectos inexplorados do controle do número de cloroplastos em células de plantas.,
um modelo de trabalho para a determinação do número de cloroplastos em células de guarda de folhas Arabidopsis
com base no que precede, propomos um modelo de trabalho (um modelo alargado 2) para a análise do número de cloroplastos em GCs (figura 1G). O número final de cloroplastos por GC é determinado pela separação do cloroplastos na divisão GMC e pela proliferação de cloroplastos em GCs. Durante a divisão GMC, os cloroplastos podem sofrer partições iguais ou desiguais. Durante a proliferação de cloroplastos, os cloroplastos GC proliferarão com competência de divisão igual (linha azul) ou selectiva (linha magenta)., Por exemplo, se cloroplastos igualmente particionados possuem competência de divisão equivalente, números iguais de cloroplastos ocorrerão no par GC (Fate 1). Se os cloroplastos particionados desigualmente possuírem competência de divisão equivalente, os cloroplastos aumentarão à mesma taxa dentro do par GC (Fate 3). Se ocorrer uma divisão seletiva de cloroplastos no GCs, o saldo do número de cloroplastos no par GC mudará após a divisão GMC (destinos 2 e 4)., Atualmente é difícil encontrar suporte para “divisão seletiva de cloroplastos”, mas se os destinos 1 e 4 realmente predominam em GCs, então eles podem possuir um mecanismo que controla o volume total de cloroplastos por célula, como nas células de mesofila folha. O modelo levanta duas questões: (i) os cloroplastos GC são devidamente particionados em células filhas e como eles se dividem? E ii) A Competência de divisão dos cloroplastos GC é regulada de forma coordenada?,
a Respeito de questão (i), se chloroplast herança ocorre pela distribuição aleatória de vários cloroplastos no citoplasma ou pela positiva chloroplast de particionamento de mecanismo(s) tem sido uma longa preocupação (Butterfass, 1969; Birky, 1983; Hennis e Birky, 1984; Nebenführ, 2007; Sheahan et al., 2016). Curiosamente, em Arabidopsis arc6, Glcs de folha ou de cotiledão têm de zero a três cloroplastos ,e em Glcs deficientes em cloroplastos, plastídeos não fotossintéticos ainda existem em formas vesiculosas a alongadas (Robertson et al., 1995; Chen et al., 2009; Fujiwara et al., 2018)., Não foram encontrados no arc6 GCs desprovidos de plastídeos per se, e não foi apresentada qualquer explicação para este facto, apesar da perturbação do aparelho de divisão de cloroplastos (Vitha et al., 2003). Assim, será importante examinar a replicação e morfologia dos cloroplastos arc6 em estudos de linhagem estomatal. Arabidopsis mutant research may also give another clue for this issue., A observação de que 18% dos GCs de cotiledão na mutante das folhas amassadas (crl) não contêm estruturas plastídicas no citoplasma, enquanto 100% das células de mesofila das folhas contêm um a quatro cloroplastos ampliados (Asano et al., 2004; Chen et al., 2009), é de grande importância. A LCR é uma proteína de invólucro externo cloroplástico com uma função desconhecida. A compreensão da função proteica CRL pode fornecer informações sobre o(s) mecanismo (s) de separação dos cloroplastos., A análise da proliferação de cloroplastos e a divisão em células de mesofila-folha em mutantes de arco Arabidopsis e outras linhas transgênicas promoveu a investigação sobre a proliferação e a divisão de plastídeos não-mesofílicos. Da mesma forma, os resultados obtidos em GCs podem ser transferíveis para outros sistemas celulares.
observação final
o Modelo GC abre muitas perspectivas para o desenvolvimento da biologia dos cloroplastos. Por exemplo, enquanto os sistemas citoesqueléticos são conhecidos por regular morfologia, movimento e particionamento de cloroplastos (Sheahan et al.,, 2016; Wada, 2016; Erickson e Schattat, 2018), o papel de cada gene regulador na proliferação de cloroplastos e particionamento em plantas recebeu pouca atenção. Por outro lado, uma vez que se torna possível diminuir o número de cloroplastos GC ou morfologia através de várias estratégias experimentais, novos insights sobre o controle molecular da morfogênese cloroplastica em células de linhagem estomatal podem ser fornecidos. Além disso, em conjunto com análises quantitativas do número de cloroplastos durante o desenvolvimento estomatal, modelagem matemática pode oferecer uma nova avenida para estas investigações., Este artigo apresenta o conhecimento atual de como o número de cloroplastos GC é controlado e destaca a potencial utilidade dos GCs de folhas Arabidopsis para a compreensão da proliferação e particionamento de cloroplastos.todos os conjuntos de dados para este estudo estão incluídos no artigo/ material suplementar.
contribuições do autor
MF concebeu o estudo e escreveu o manuscrito. MF e as conduziram as experiências. AS e RI realizaram as análises. Todos os autores lêem e aprovam o manuscrito final.,
Financiamento
Este trabalho foi apoiado pelo Ministério da Educação, Cultura, Ciência e Tecnologia do Japão em KAKENHI (grant, nº. 19K05831 para MF e 18K06314 RI).
conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
os autores agradecem ao Dr. Nobuyuki Kanzawa (Universidade Sophia) por conselhos sobre o trabalho.
Birky, C. W., Jr. (1983)., Particionamento de organelas citoplásmicas na divisão celular. T. Rev. Cytol. 15, 49-86.
Google Scholar
butter churn, T. (1969). A distribuição plastida na mitose das células-mãe de células-mãe de haploid swedenklee (Trifolium hybridum L.). Planta 84, 230-234. doi: 10.1007 / BF00388108
PubMed Abstract | CrossRef Full Text | Google Scholar
butter churn, T. (1973). Controlo da Divisão de plastídeos através da quantidade de ADN nuclear. Protoplasm 76, 167-195. doi: 10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., Número de plastídeos e alterações estruturais dos plastídeos associadas à cultura de protoplastos mesofílicos do tabaco e à regeneração vegetal. Planta 158, 329-338. doi: 10.1007/BF00397335
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Tirlapur, U. K., König, K. (2001). Os lasers quase infravermelhos femtossegundo como uma nova ferramenta para imagens em tempo real não invasivas de alta resolução de divisão de cloroplastos em células de bainha de Arabidopsis. Planta 214, 1-10. doi: 10.,1007 / s004250100597
PubMed Abstract | CrossRef Full Text/Google Scholar
Wild, A., Wolf, G. (1980). O efeito de diferentes intensidades de luz na frequência e tamanho dos estomas, o tamanho das células, o número, tamanho e teor de clorofila dos cloroplastos no mesofilo e nas células de guarda durante a ontogenia das folhas primárias do Sinapis alba. Z. Pflanzenphysiol. Bd. 97, 325–342. doi: 10.1016/S0044-328X(80)80006-7
CrossRef Texto Completo | Google Scholar
















Deixe uma resposta