manejo da aloimunização materna
como regra, títulos em série de anticorpos maternos são monitorados até um título crítico de 1:32, o que indica que um alto risco de hidropisia fetal foi atingido. Neste ponto, o feto requer um monitoramento muito intenso para sinais de anemia e hidropisia fetal., In Kell alloimmunization, hydrops can occur at low maternal titers because of supressão da eritropoiese, and, thus, a titer of 1: 8 has been suggested as critical. Assim, os valores delta-OD 450 também não são confiáveis na previsão da gravidade da doença na aloimunização de Kell. os títulos maternos não são úteis na previsão do início da anemia fetal após a primeira gestação afectada. Grandes diferenças no título podem ser vistas no mesmo paciente entre laboratórios diferentes, e uma técnica de gel mais recente produz resultados de título mais elevados do que o método do tubo mais antigo., Por conseguinte, deve utilizar-se a metodologia padrão do tubo para determinar o título crítico e uma alteração de mais de 1 diluição representa um verdadeiro aumento do título de anticorpos maternos. Para todos os anticorpos responsáveis pela doença hemolítica do recém-nascido (HDN), um aumento de 4 vezes em qualquer título de anticorpos é tipicamente considerado uma mudança significativa que requer avaliação fetal.
quando indicado, a amniocentese pode ser realizada logo nas 15 semanas de gestação (raramente necessária na primeira gravidez afectada antes das 24 semanas de gestação) para determinar o genótipo fetal e avaliar a gravidade., As amostras de sangue materno e paterno devem ser enviadas para o laboratório de referência com uma amostra de líquido amniótico para eliminar resultados falsos-positivos (de pseudogeno materno ou gene Ccde) e falsos-negativos (de um rearranjo no locus do gene RHD no Pai).a determinação do genótipo RH Fetal no plasma materno tornou-se rotina em muitos países europeus e está a ser oferecida nos Estados Unidos., O ADN sem células fetais é responsável por 3% do ADN plasmático materno total circulante, é encontrado logo nos 38 dias de gestação, e é derivado da apoptose da camada placentária de citotrofoblast. A semi-vida média do ADN fetal circulante é, em média, inferior a 30 minutos, e o plasma materno é submetido a filtração e microcentrifugação para remover todos os elementos celulares antes do teste. Isto elimina resultados falsos-positivos de células fetais gravadas de gravidezes anteriores em órgãos linfóides maternos.,
o ADN fetal livre de células é submetido a reacção em cadeia da polimerase em tempo real (PCR) para detecção da presença de sequências específicas do gene RHD, tendo-se verificado que tem uma precisão de 99, 5% dos casos. O gene SRY (no feto masculino) e polimorfismos de DNA na população em geral (no feto feminino) são usados como controles internos para confirmar a origem fetal do DNA livre de células. Um painel de 92 polimorfismos de nucleótidos simples (SNPs) é comparado entre a amostra materna do revestimento buffy e o plasma., Uma diferença de mais de 6 SNPs confirma a presença de DNA fetal e a validade do teste em um feto feminino. Os resultados falsos negativos, sendo os mais indesejáveis e consequentes, devem-se a fenótipos D parciais ou fracos. Eles são detectados usando pelo menos dois primers de exon específicos RHD e executados em duplicados.
felizmente,o teste de ADN fetal sem células para determinar o genótipo de outros antigénios dos glóbulos vermelhos, tais como c, C, E, E e Kell, também é agora considerado altamente fiável e preciso.,
amniocentese Serial é iniciada a intervalos de 10-14 dias para monitorizar a gravidade da doença no feto. Todas as tentativas devem ser feitas para evitar a passagem transplacentária da agulha, o que pode levar a hemorragia fetomaternal (FMH) e um aumento adicional no título de anticorpos. Os valores de delta-O 450 em série são plotados na carta de Queenan ou na carta de Liley estendida para avaliar o risco de hidropisia fetal. A ultra-sonografia precoce é realizada para estabelecer uma idade gestacional correta., A monitorização ultrassonográfica frequente também é realizada para avaliar o bem-estar fetal e para detectar anemia moderada e sinais precoces de hidropisia.
a velocidade máxima da artéria sistólica média (MCA) Doppler provou ser uma ferramenta de triagem confiável para detectar anemia fetal e substituiu a amniocentese. O MCA é facilmente visualizado com Doppler de fluxo de cores; Doppler pulsado é então usado para medir a velocidade sistólica de pico apenas distal a sua bifurcação a partir da artéria carótida interna., Como a velocidade MCA aumenta com o avanço da idade gestacional, o resultado é relatado em múltiplos da mediana (mães). Em estudos recentes, a sensibilidade para a detecção de anemia fetal moderada e grave tem sido comprovada como sendo 100%, com uma taxa falsa-positiva de 10% a 1,5 mãe. Demonstrou-se reduzir em mais de 70% a necessidade de procedimentos diagnósticos invasivos como a amniocentese e a cordocentese.
MCA os estudos Doppler podem ser iniciados desde as 18 semanas de gestação, mas não são fiáveis após as 35 semanas de gestação., Também tem sido usado para cronometrar a subsequente transfusão fetal e para diagnosticar anemia de causas múltiplas, como em transfusão de gêmeos. O declive MCA a partir de leituras de 3 semanas é agora usado para prever o risco fetal para anemia grave (ver a imagem abaixo).
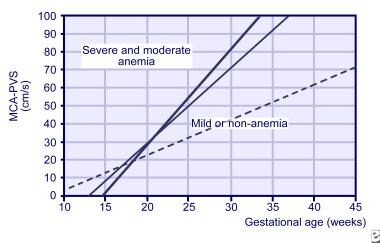 declives for peak systolic velocity in middle cerebral artery (MCA) for normal fetos (track line), mildly anemic fetos (thin line), and severely anemia fetos (thick line).,
declives for peak systolic velocity in middle cerebral artery (MCA) for normal fetos (track line), mildly anemic fetos (thin line), and severely anemia fetos (thick line)., com aquisição de experiência na realização do estudo Doppler MCA, a amniocentese serial para a detecção da anemia fetal tem sido utilizada em menor extensão.
durante o período em que a transfusão peritoneal intra-uterina foi o único meio de tratamento, os recém-nascidos foram regularmente entregues às 32 semanas de gestação. Esta abordagem resultou em uma alta incidência de doença da membrana hialina e transfusões de troca., Com o advento da transfusão intravascular (TIV) in utero, a abordagem geral para o feto severamente afetado é realizar a TIV conforme necessário até 35 semanas de gestação, com o parto planejado no prazo. O estabelecimento da maturidade pulmonar é difícil nestes fetos devido à contaminação do líquido amniótico com sangue residual durante a transfusão; no entanto, se o parto for planeado antes das 34 semanas de gestação, está indicada a administração materna de esteróides para aumentar a maturidade pulmonar fetal.,
além disso, os níveis de bilirrubina do fluido amniótico em excesso causam uma falsa elevação no teste de despolarização da fluorescência TDx do pulmão fetal, versão II (TDX-FLMII); portanto, devem ser utilizados outros testes para determinar a maturidade do pulmão fetal, tais como espectroscopia infravermelha, contagem do corpo lamelar, quantificação de fosfatidilglicerol ou relação lecitina/esfingomielina (L/S).
Liley descreveu pela primeira vez transfusão intraperitoneal (IPT) em 1963. Uma agulha Tuohy é introduzida na cavidade peritoneal fetal sob orientação ultra-sonográfica., Um cateter epidural é colocado através da agulha. Um meio radiopaco é injectado no peritoneu fetal. A colocação adequada é confirmada por delineamento fora do intestino ou sob o diafragma ou por difusão em ascite fetal.,ss de 4 dias de idade, do grupo O, Rh negativo, Kell-negativo, leukoreduced, irradiadas com 25 Gy para evitar enxerto versus hospedeiro da doença, e a cruz de correspondência com soro materno são injetados em 10 mL de alíquotas para um volume calculado pela fórmula a seguir:
IPT volume = (gestação em semanas – 20) × 10 mL
Residual de hemoglobina (Hb) em que o feto está estimado para permitir o espaçamento adequado do IPT e seleção de gestação de entrega pela fórmula a seguir:
Hb g/dL = 0.,85/125 × a/b × 120 – c/120
Na fórmula, um é a quantidade de doadores de RBC Hb transfundidos, b é a estimativa do peso corporal fetal, e c é o intervalo em dias de tempo de transfusão o tempo de doadores de Hb estimativa.
IPT é repetido quando se estima que o Hb fetal tenha diminuído para 10 g / dL. Normalmente, um segundo IPT é realizado 10 dias após a primeira transfusão para aumentar a Hb acima de 10 g/dL. Em seguida, outra transfusão é realizada a cada 4 semanas até o momento da entrega planejada em 34-35 semanas de gestação., São necessários movimentos diafragmáticos fetais para que a absorção do RBC ocorra. Esta abordagem não tem qualquer valor para um feto moribundo que não seja ameaçado. As complicações maternas incluem infecção e hemorragia transplacentária, enquanto as complicações fetais são sobretransfusão, exsanguinação, tamponamento cardíaco, infecção, trabalho de parto prematuro, e doença enxerto versus hospedeiro. As taxas de sobrevivência após o IPT aproximaram-se aproximadamente de 75% com a ajuda de ultra-sonografia.,
IVT directa tornou-se uma via preferida de intervenção fetal devido à maior taxa de complicações e eficácia limitada da IPT num feto com tropismo hidrópico. Rodeck realizou pela primeira vez com sucesso a IVT em 1981. Com orientação ultrasonográfica, introduz-se uma agulha de calibre 20-22 numa veia umbilical na inserção do cordão na placenta ou na sua porção intra-hepática, obtendo-se uma amostra de sangue fetal. Confirma-se que a amostra de sangue é de origem fetal por um teste rápido de desnaturação alcalina., São realizados todos os testes fetais relevantes (por exemplo, tipo sanguíneo, teste directo de anticorpos, Contagem de reticulócitos, Contagem de plaquetas, nível de Hb, nível de Hct, nível sérico de albumina, nível de eritropoetina). Se o nível de Hb for inferior a 11 g/dL ou se o nível de Hct for inferior a 30%, inicia-se uma TIV. A posição da agulha é confirmada notando a turbulência no recipiente fetal na injecção de solução salina. O feto fica frequentemente paralisado com pancurónio e recebe fentanilo 10 mcg/kg para prevenir o deslocamento da agulha por movimentos fetais., A medicação materna varia de apenas anestésico local, à indometacina de rotina e sedação consciente, à analgesia epidural espinal.
a transfusão é realizada em alíquotas de 10 mL até um volume estimado de aproximadamente 50 mL/kg de peso corporal, utilizando ultra-sonografia ou até ser atingido um nível de Hct de 40%. O procedimento é imediatamente interrompido se for detectada descompensação cardíaca nos resultados de ultra-sonografia., Fetos gravemente anémicos não toleram a correcção aguda da sua Hct aos valores normais, e a Hct inicial não deve ser aumentada em mais de 4 vezes na altura da primeira TIV. Devem, então, ser monitorizados a cada 2-7 dias. A TIV é repetida quando atinge um valor que reflete anemia crítica no feto. Pode prever-se uma perda de 1% das células transfundidas por dia. alguns centros efectuam transfusões repetidas em intervalos de 10 dias, 2 semanas e de 3 em 3 semanas. Outros transfusionam com base em um declínio antecipado na hemoglobina fetal de 0,4 g / dL / dia, 0,3 g / dL / dia, e 0.,2 g / dL / dia para os intervalos da primeira, segunda e terceira transfusão, respectivamente. A velocidade MCA sistólica máxima tem sido usada para cronometrar a segunda transfusão, com um limiar de 1,32 mãe. Após a primeira transfusão intra-uterina, a presença de glóbulos vermelhos com hemoglobina adulta suprimir a eritropoiese e melhorar o fornecimento de oxigénio, o que é responsável pela fraca correlação entre a velocidade MCA máxima e gravidade da anemia fetal. Alguns centros encontraram um efeito benéfico da transfusão combinada de TIV e TIP no intervalo para repetir a transfusão., foram notificados casos de bradicardia fetal transitória, hematoma do cordão, compressão das veias umbilicais e morte fetal durante a TIV. No entanto, a TIV tem muitas vantagens, incluindo correção imediata da anemia e resolução de hidrops fetais, redução da taxa de hemólise e hiperinsulinemia subseqüente, e aceleração do crescimento fetal para fetos não-hidropicos que são muitas vezes retardados de crescimento. A TIV é a única intervenção disponível para fetos hidrópicos moribundos e aqueles com placenta anterior. O risco de perda fetal é de cerca de 0, 8% com TIV versus 3.,5% por procedimento para IPT e a taxa de sobrevivência global é de 88%.
Recentemente lavados materna Hemácias têm sido utilizados com sucesso como fonte de antígeno-negativa de Hemácias em caso de rara incompatibilidade, mas também têm sido rotineiramente utilizados devido a benefícios como a diminuição do risco de sensibilização para novos antígenos de glóbulos vermelhos, uma maior circulação de meia-vida ser doce, e diminuição do risco de transmissão de agentes virais. A mãe pode doar uma unidade de glóbulos vermelhos após o primeiro trimestre.,
No caso de imaturidade pulmonar e delta-OD 450 na zona afectada da curva de Queenan, a administração oral de 30 mg de fenobarbital à mãe 3 vezes por dia, seguida de indução numa semana, reduz a necessidade de transfusão no recém-nascido afectado. Excelentes algoritmos para a gestão da primeira gravidez afetada e da gravidez em uma mãe com feto previamente afetado são descritos em uma revisão por Moise (ver as imagens abaixo).
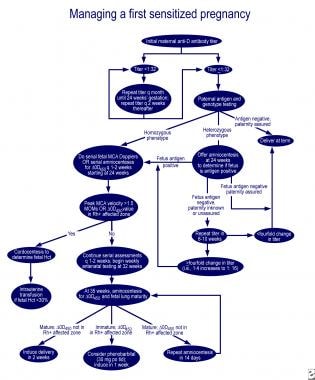 Gestão da primeira gravidez afectada.,
Gestão da primeira gravidez afectada., 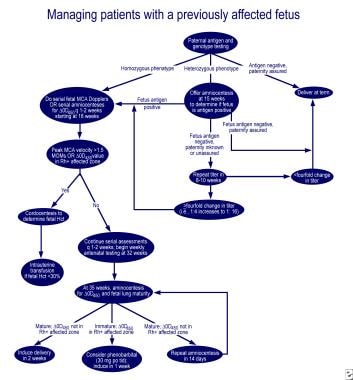 Gestão de mulheres grávidas com feto anteriormente afectado.
Gestão de mulheres grávidas com feto anteriormente afectado. as tentativas iniciais de suprimir a produção de anticorpos Rh com hapten, estroma Rh-positivo RBC, e a administração de prometazina não foram bem sucedidas. A plasmaférese extensa com substituição parcial utilizando 5% de albumina (troca plasmática terapêutica) e imunoglobulina intravenosa (IVIG) ou a administração de IVIG a 1 g/kg de peso corporal por semana demonstrou ser moderadamente eficaz., O mecanismo de Acção parece ser o bloqueio dos receptores Fc na placenta, reduzindo o transporte de anticorpos para o feto, os receptores Fc nos fagócitos no sistema reticuloendotelial fetal e a inibição de feedback da síntese materna de anticorpos. Contudo, a citotoxicidade mediada por células e o aumento da concentração de anticorpos, Alteração do fluxo sanguíneo placentário durante o procedimento e hemorragia pós-parto foram observados após a troca plasmática., um estudo retrospectivo mais recente, que incluiu 5 mulheres grávidas com HDFN grave devido à alimunização de RBC, relatou sucesso no tratamento com um regime combinado de troca terapêutica de plasma, IVIG e transfusão intra-uterina (IUT) no início da gravidez. As mulheres foram submetidas a 3 procedimentos de troca de plasma durante as semanas 10-13 da gravidez, após perfusões semanais de IVIG; os fetos receberam unidades de RBC que correspondiam totalmente o fenótipo materno aos grupos de D, C, E, K, Fy, Jk e antigénios S. Todas as mulheres deram à luz crianças saudáveis nas 33-38 semanas de gestação.,
No entanto, estas técnicas apenas adiam a necessidade de amostragem percutânea de sangue umbilical (PUBS) e de FIV até 20-22 semanas de gestação, quando estes procedimentos podem ser realizados com um risco mais aceitável. Uma revisão do uso de IVIG mostra sua utilidade na prevenção do início das hidrelétricas fetais e no atraso da necessidade de IUT., Assim, uma abordagem combinada de plasmaferese, que começa às 12 semanas de gestação 3 vezes na semana, seguido pelo IVIG em um carregamento de dose de 2 g/kg após a terceira plasmaferese e, em seguida, continuou IVIG 1 g/kg/semana até 20 semanas de gestação tem sido sugerido por em risco os fetos antes de 20 semanas de gestação e também pode ser usado mais tarde na gestação se IVT não pode ser executada ou se hidropisia é responder a IVT.,
um relatório indicou que o tratamento de fetos com aloimunização grave utilizando TIV combinada com a terapêutica fetal IVIG a 1 g/kg / dose a partir do terceiro TIV ajudou a reduzir a frequência de TIV e a melhorar os sinais de hidropisia. Um relatório de casos mostra um tratamento bem sucedido de anemia grave e hidropisia em um feto com aloimunização devido a anticorpos anti-M com injeções fetais intraperitoneais de IVIG 2 g/kg administrados semanalmente a partir de 30 semanas. No entanto, este foi um relatório de caso, e um teste controlado randomizado é necessário antes que isso pode se tornar padrão de cuidados.,
Semelhante regimes de exames e de tratamento são utilizados na gestão das gestações afetadas pela nonRhD aloimunização, tais como anti-Rhc, anti-K (K1), e anti-M. uma Vez que a mãe é diagnosticada com um anticorpo associado com doença hemolítica, uma Coombs indireto de titulação é realizada, juntamente com paternal testes envolvidos antigen e zigoticidade. Os títulos maternos são repetidos (mensalmente até 28 semanas de gestação e, em seguida, a cada 2 wk) até que um limiar para anemia fetal é atingido (1:8 para Kell e 1:32 para repouso).,a tipagem do antigénio Fetal é efectuada através de amniocentese ou ADN fetal sem células no plasma materno, se o pai for heterozigótico (100% para a K1, 65% para A M). Quando o feto é conhecido como antigénio positivo, a vigilância para anemia fetal grave é realizada, com rastreio semanal MCA Doppler tão cedo quanto 16-18 semanas e IUT é realizada se exceder 1,5 mãe com um parto até 38 semanas de gestação. demonstrou-se que os aloanticorpos maternos aos leucócitos paternos provocam bloqueio Fc e reduzem a gravidade da anemia hemolítica fetal., Isto pode ser usado no futuro.
a gestão do recém-nascido sensibilizado
a doença hemolítica ligeira representa 50% dos recém-nascidos com resultados positivos nos testes de anticorpos directos. A maioria destes recém-nascidos não são anêmicos (cabo de hemoglobina >14 g/dL) e ter o mínimo de hemólise (cabo de bilirrubina < 4 mg/dL). Para além da fototerapia precoce, não requerem transfusões. No entanto, estes recém-nascidos estão em risco de desenvolver anemia tardia grave por 3-6 semanas de vida. Por conseguinte, é importante monitorizar os seus níveis de Hb após a alta hospitalar.,
a doença hemolítica moderada representa aproximadamente 25% dos recém-nascidos afectados. A doença hemolítica moderada do recém-nascido é caracterizada por anemia moderada e níveis aumentados de bilirrubina do cordão umbilical. Estas crianças não são clinicamente icterícia no nascimento, mas desenvolvem rapidamente hiperbilirrubinemia não conjugada nas primeiras 24 horas de vida. O esfregaço periférico mostra numerosos glóbulos nucleados, diminuição de plaquetas e, ocasionalmente, um grande número de granulócitos imaturos., Estes recém-nascidos têm frequentemente hepatosplenomegalia e estão em risco de desenvolver encefalopatia bilirrubina sem tratamento adequado. Transfusão precoce com tipo-O Rh-negativo RBC fresco com fototerapia intensiva é geralmente necessária. A utilização de IVIG em doses de 0, 5-1 g/kg num regime de dose única ou múltipla foi capaz de reduzir eficazmente a necessidade de transfusão.,
um estudo controlado aleatorizado prospectivo demonstrou a administração precoce de doses elevadas de IVIG 1 g / kg às 12 horas de idade, para reduzir a duração da fototerapia e da estadia no hospital e prevenir a troca de transfusões em recém-nascidos com isoimunização Rh moderada a grave. Estes recém-nascidos também estão em risco de desenvolver anemia hiporegenerativa tardia da infância em 4-6 semanas de vida. No entanto, um ensaio aleatorizado, em dupla ocultação, controlado com placebo, não mostrou o benefício da terapêutica profiláctica IVIG 0.,75 g / kg no período de 4 horas de idade em recém-nascidos gravemente afectados que foram tratados com transfusão intra-uterina para a isoimunização da HR.
a doença hemolítica grave é responsável pelos restantes 25% dos recém-nascidos aloimunizados que são nados-mortos ou hidrópicos à nascença. O hidropisia fetal é predominantemente causada por uma síndrome de vazamento capilar devido à hipoxia tecidular, hipoalbuminemia secundária à disfunção hepática, e insuficiência cardíaca de alta potência por anemia., Cerca de metade destes fetos tornam-se hidrópicos antes de 34 semanas de gestação e precisam de monitoramento intensivo e gestão da gestação aloimmunizada, como descrito anteriormente. Leve hidropisia envolvendo ascite inverte com IVTs em apenas 88% dos casos, com maior sobrevivência, mas graves, hidropisia fetal, causando edema do couro cabeludo e grave, ascite e derrame pleural inversa em 39% dos casos e está associada a uma baixa sobrevivência.
Gestão da incompatibilidade ABO
gestão da hiperbilirrubinemia é uma das principais preocupações nos recém-nascidos com incompatibilidade ABO., Os critérios para a transfusão de troca e fototerapia são semelhantes aos utilizados na aloimunização de Rh. IVIG também tem sido muito eficaz quando administrado no início do curso. Estanho (Sn) porfirina um potente inibidor da heme oxigenase, a enzima que catalisa a limitação de taxa de etapa na produção de bilirrubina a partir de heme, tem sido mostrado para reduzir a produção de bilirrubina e reduzir a necessidade de transfusão de troca e a duração da fototerapia em recém-nascidos com incompatibilidade ABO.
Tin ou zinco protoporfirina ou mesoporfirinas foram estudados em recém-nascidos., Devem ser administrados por via intramuscular numa dose baseada no peso corporal, e a sua eficácia parece estar relacionada com a dose em todas as gestações. Seus possíveis efeitos tóxicos incluem fotossensibilização da pele, deficiência de ferro e possível inibição da produção de monóxido de carbono. A sua utilização na doença hemolítica de Rh de recém-nascidos não foi notificada. A sua utilização de rotina ainda não pode ser recomendada devido à falta de dados de segurança a longo prazo.
















Deixe uma resposta