D Kelly1, G Crotty1, J O’Mullane2, M Stapleton2, B Sweeney1, SS S’Sullivan1
os Departamentos de 1Neurology e 2Biochemistry, Cork University Hospital, Wilton, Cortiça
Resumo
O primeiro passo na avaliação de potenciais doença de Wilson é séricos de ceruloplasmina de testes, no qual um nível inferior a 0,2 g/L é sugestivo da doença., Procurámos determinar qual a proporção de uma população irlandesa com um baixo nível de ceruloplasmina, se as medições baixas foram adequadamente seguidas e quais os resultados clínicos. Realizámos uma revisão retrospectiva de todas as medições da ceruloplasmina sérica entre agosto de 2003 e outubro de 2009 num grande centro de referência terciário no sul da Irlanda. Os dados clínicos, ceruloplasmina sérica, testes da função hepática, relatórios urinários de biópsia de cobre e fígado foram todos registados quando disponíveis. 1573 doentes apresentaram uma medição da ceruloplasmina sérica durante o período de 7 anos do estudo. 96 doentes (6.,1%) tinha um nível de ceruloplasmina
0, 2 g/L e destes apenas 3 doentes tinham doença de Wilson. Só houve um novo diagnóstico. Apenas 27 doentes (28, 1%) apresentaram algum tipo de teste de confirmação. Segundo a experiência do nosso centro, o valor preditivo positivo de um nível significativamente baixo de ceruloplasmina é de 11,1% (95% IC 2,91-30,3%). Na prática, uma medição baixa da ceruloplasmina sérica não é frequentemente seguida de testes de confirmação adequados., A medição da ceruloplasmina sérica como um teste de diagnóstico singular para a doença de Wilson ou como parte da bateria de testes de rastreio do fígado não selecionados é inadequada e de baixo rendimento.a doença de Wilson (DT) é um defeito recessivo autossómal raro no transporte hepatocelular de cobre encontrado em 3 em cada 100 000 pessoas. Pode levar à deposição crónica de cobre no fígado, cérebro e outros tecidos, resultando em hepatotoxicidade e sequelas neuropsiquiátricas2., A American Association for the Study of Liver Disease (AASLD) recomenda o rastreio de DMO em qualquer indivíduo com idades compreendidas entre os 3 e os 55 anos com anomalias hepáticas de causa incerta, especialmente aqueles com desordenamentos neurológicos inexplicados Co-mórbidos 3. O primeiro passo no rastreio de uma potencial DD é a medição da ceruloplasmina sérica, uma vez que aproximadamente 85 a 90% dos doentes com DD têm níveis séricos baixos de ceruloplasmina 4., No entanto, a baixa ceruloplasmina não é específica para a DQA; pode resultar de má absorção, outras doenças hepáticas, enteropatias que perdem proteínas, deficiência adquirida em cobre, e aceruloplasminemia5 hereditária. A ceruloplasmina é também um reagente de fase aguda e pode ser elevada em estados inflamatórios, incluindo doentes com doença hepática activa (6). Os Estados hiper-estrogénicos, incluindo a gravidez ou o uso da pílula contraceptiva oral, também podem aumentar os níveis de ceruloplasmina, uma vez que a mRNA da ceruloplasmina tem uma região que responde ao estrogénio a montante para a sua transcriptação7. Níveis de ceruloplasmina inferiores a 0.,2g / L foi demonstrado em um estudo ter uma sensibilidade superior a 98%, especificidade superior a 55% e valor preditivo positivo superior a 48% para o diagnóstico de DM em patients verificados por genótipo 8.no entanto, outras pesquisas sugerem que o valor preditivo positivo da ceruloplasmina <0, 2 g/L quando usado isoladamente em doentes com disfunção hepática pode ser tão baixo quanto 5, 9% 1. Por esta razão, as orientações recomendam uma série de testes de confirmação, incluindo um exame com lâmpada de fenda para detecção de anéis Kayser-Fleischer (KF) e uma estimativa de cobre urinário de 24 horas 3., Investigações adicionais podem ser necessárias para aqueles com resultados indeterminados, incluindo uma biópsia hepática para determinar a concentração hepática de cobre ou testes moleculares para mutações ATP7B9,10. A Associação Europeia para o Estudo do Fígado (EASL) diretrizes de prática clínica também reconhece as limitações dos níveis séricos de ceruloplasmina de medição como um único teste e recomenda o uso de uma combinação de testes que refletem ‘perturbado cobre o metabolismo”, com um diagnóstico do sistema de pontuação baseado em suas resultados11., Nosso estudo avaliou a incidência de baixos níveis de ceruloplasmina na população e as indicações clínicas para testes. Determinamos se foram realizados mais testes de diagnóstico e qual foi o significado clínico destes resultados.
Methods
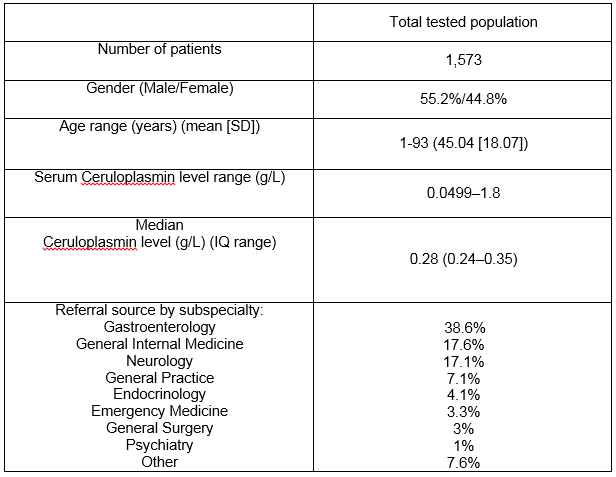
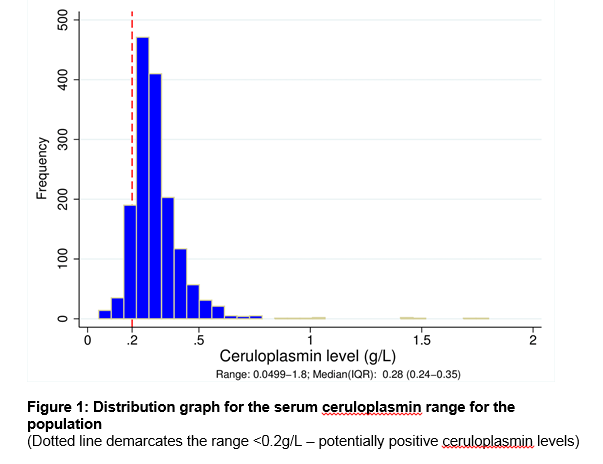
We conducted a retrospective review of all ceruloplasmina measurements at the Cork University Hospital clinical laboratory that serves a large primary care network, specialty clinics, and an 800-bed tertiary neurological and hepatological referral centre between August 2003 and October 2009., O período de tempo foi escolhido para incluir os dados máximos disponíveis. O estudo foi aprovado pelo Comitê de ética hospitalar. Os dados clínicos, ceruloplasmina sérica, testes da função hepática, relatórios urinários de biópsia de cobre e fígado foram todos registados quando disponíveis. A nefelometria foi a técnica utilizada pelo laboratório de referência para a medição da ceruloplasmina sérica durante o período de estudo. Tratámos os valores de ceruloplasmina inferiores a 0,2 g / L como potencialmente positivos para a DM, de acordo com as directrizes publicadas 3., Um diagnóstico de DM foi determinado com base nos resultados de testes de confirmação (urina e cobre hepático, exames oftalmológicos) e documentação de registo médico. Os resultados dos testes genéticos foram registados quando disponíveis. Heterozigotos WD foram definidos como aqueles com apenas uma mutação causadora de doença na ausência de outras características de suporte. Os dados foram analisados utilizando a versão 21 do SPSS.o nosso laboratório em Cork city, na Irlanda, serve como centro supra-regional para uma população total de 1,1 milhões de pessoas., Havia 1573 doentes na base de dados laboratorial que tinham uma medição da ceruloplasmina sérica durante o período de 7 anos do estudo. A tabela 1 descreve os detalhes demográficos e a fonte de referência por especialidade clínica. Um total de 476 níveis séricos de ceruloplasmina (30, 3%) foram ordenados em doentes com idade inferior a 3 anos ou superior a 55 anos, um grupo fora das recomendações da AASLD3. Ver Figura 1 para a gama de níveis de ceruloplasmina em toda a população. O nível médio de ceruloplasmina foi de 0, 28 g / L (5 ° C = 0, 18, 95 ° C = 0, 5 g/L)., Houve uma diferença significativa no nível mediano para homens e mulheres com 0, 27 g/L e 0, 3 g/L respectivamente (p<0, 05). Houve uma fraca correlação positiva entre a idade e o nível de ceruloplasmina com idades inferiores associadas ao nível de ceruloplasmina inferior, r =.124, n = 1573, p <.0005.
Tabela 1:
Positivo ceruloplasmina resultados
96 pacientes (masculino:feminino = 72%:28%) de toda a coorte (6.1%) tinha um ceruloplasmina nível <0.,2g / L (ver Figura 1). As indicações mais comuns para os testes foram a presença de anormalidades nos testes da função hepática (61, 5%), uma desordem de movimento (18, 8%) e perturbações psiquiátricas (7, 3%). 40,6% do grupo foram posteriormente submetidos a um diagnóstico definitivo de doença hepática, sendo a mais comum a doença hepática alcoólica (14,6%) seguida de doença hepática gorda não alcoólica (8,3%). Apenas 3 dos 96 doentes (3, 1%) apresentaram DMO. Dois destes doentes tinham sido previamente diagnosticados e foram submetidos a novo teste para monitorização da doença. Um doente foi diagnosticado de novo com DM durante o período de estudo., Sua elevada excreção urinária de cobre 24 horas, anéis Kayser-Fleisher juntamente com baixo nível sérico de ceruloplasmina confirmou o diagnóstico. Todos os 3 Doentes com DD tinham uma ceruloplasmina
0, 05 g/L. Além disso, um indivíduo que apresentava tremor foi identificado como um portador de DD apenas com uma mutação ATP7B única. Sua análise genética não foi consistente com um composto heterozigoto e ele nunca desenvolveu mais sintomas clínicos.teste de confirmação para a doença de Wilson após um resultado positivo / sugestivo de ceruloplasmina, 27/96 doentes (28.,1%) teve algum tipo de teste de confirmação para WD realizado. 14 doentes (14, 5%) foram examinados oftalmologicamente para anéis Kayser-Fleisher. 10 doentes (10, 4%) foram submetidos a uma biópsia hepática para quantificação hepática do cobre. 23 doentes (24%) apresentaram quantificação urinária do cobre. O período médio de acompanhamento a partir da altura dos testes iniciais foi de 51, 4 meses (DP 30, 3 meses). As subespecialidades não-Neurologia/Gastroenterologia eram significativamente menos propensas a realizar investigações de seguimento. (p<0,01). Apenas 4 dos 27 doentes (14.,8%) que tinham mais testes estavam sob os cuidados das subespecialidades não-Neurologia/Gastroenterologia.a ceruloplasmina como um teste de diagnóstico de rastreio, a discussão sobre a ceruloplasmina é frequentemente questionada na avaliação e gestão do doente com elevação das enzimas hepáticas. Em nossa revisão de 7 anos de padrões de ordenação de ceruloplasmina, encontramos má adesão às diretrizes da AASLD. Uma proporção significativa da população testada estava fora da faixa etária recomendada pelo AASLD. É muito incomum apresentar a doença de Wilson após a idade de 4012., Em uma grande revisão retrospectiva dos níveis de ceruloplasmina em 5023 pacientes, o número necessário para testar a doença de Wilson de início tardio (>40 anos de idade) para resultar em um novo diagnóstico foi 284713. Em muitos casos, as anormalidades hepáticas não foram de etiologia incerta e doenças mais comuns ainda não foram excluídas. Vários dos doentes com baixos níveis de ceruloplasmina apresentavam hepatite crónica ou doença hepática induzida pelo álcool-condições associadas a resultados falsos positivos secundários à função sintética hepática deficiente 1., Menos de 30% da população do estudo tiveram investigações de seguimento adequadas para um resultado positivo da ceruloplasmina, como exame oftálmico para anéis KF ou biópsia hepática para coloração de cobre. As medições da ceruloplasmina foram solicitadas por uma variedade de subespecialitos, sendo os mais comuns a gastroenterologia, neurologia e internistas. A razão mais comum para o teste foi para a avaliação da elevação das enzimas hepáticas ou doença hepática estabelecida. Os médicos que não eram gastroenterologistas ou neurologistas tinham menor probabilidade de realizar investigações confirmatórias (p
0, 01)., Isto sugere falta de familiaridade de outras subespecialidades com o algoritmo de diagnóstico de investigações necessárias para confirmar ou excluir WD.a medição da ceruloplasmina sérica com um nível-limite inferior a 0,2 g / L teve um baixo PPV para WD no nosso estudo semelhante ao trabalho publicado anteriormente1. Isto relaciona-se com a baixa probabilidade pré-teste do diagnóstico em uma população não selecionada com uma elevada prevalência de doença hepática com etiologia conhecida. A redução da Gama de referência para 0.14 teria melhorado o desempenho do ensaio sem afectar negativamente a sensibilidade., Foi notificada uma maior precisão de diagnóstico com este limiar inferior em estudos anteriores, com uma ressalva da validação local necessária8. Neste estudo, a séricos de ceruloplasmina concentrações inferiores a 0.20, 0.14, e 0,10 g/L mostrou preditivo positivo de valores de 48.3%, 100% e 100%, respectivamente, No grupo de validação, uma séricos de ceruloplasmina limite de 0,14 g/L prestados 100% de sensibilidade e especificidade. No entanto, é possível que nem todos os pacientes com WD foram capturados com base neste teste de triagem., Como mencionado anteriormente, pode haver falsos resultados negativos para A Dm Em face de infecção ou inflamação14. Gravidez e terapêutica suplementar com estrogénios podem ter um impacto semelhante15. Os futuros pedidos/interpretações de testes devem ter em conta estes factores clínicos atenuantes. O método de ensaio pode influenciar os resultados. A ceruloplasmina sérica pode ser medida enzimaticamente pela sua actividade oxidase dependente do cobre para substratos específicos ou por ensaios dependentes de anticorpos. Este último inclui nefelometria, radioimmunoassay e imunodifusão radial., Os resultados são geralmente semelhantes, exceto para os testes dependentes de anticorpos e imunodifusão, que podem sobrestimar os níveis de ceruloplasmina. A sobrestimação pode ocorrer porque os dois métodos de ensaio não diferenciam entre apoceruloplasmina (ceruloplasmina não ligada ao cobre) e holoceruloplasmina (ceruloplasmina com o seu complemento completo de 6 átomos de cobre por molécula)16. Nefelometria foi a técnica usada consistentemente durante todo o nosso período de estudo.este estudo teve várias limitações. Não acompanhámos os doentes com valores normais (>0.,2G / L) níveis séricos de ceruloplasmina para garantir que não desenvolveram uma DMO subsequentemente. Assim, podemos não ter capturado as características de teste de todos os pacientes afetados. A nossa capacidade de avaliar a ceruloplasmina como um teste de diagnóstico foi limitada, uma vez que só podíamos incluir medições onde o teste de confirmação definitivo foi realizado. Além disso, é possível que o portador heterozigoto que identificamos tenha, de fato, WD com um fenótipo menos grave., Dado que a maioria dos pacientes com DT são heterozigotos compostos e que existem muitas mutações específicas da doença, pode ser difícil diferenciar um portador saudável de um indivíduo afetado17. O rastreio de rotina de todos os doentes é de utilidade clínica limitada e a ceruloplasmina não deve ser utilizada como parte da bateria empírica de testes que formam o painel hepático. O uso mais criterioso da ceruloplasmina em uma população selecionada com uma maior probabilidade de pré-teste da doença de Wilson pode aumentar sua utilidade como uma ferramenta de triagem., Sistemas de pontuação diagnóstica como o proposto pela EASL11 podem ajudar a estratificar o risco ou contextualizar um baixo resultado sérico de ceruloplasmina. Há uma clara necessidade de uma maior educação no que diz respeito às indicações adequadas para a realização de testes de ceruloplasmina em todas as especialidades clínicas referidas, mas em particular em fontes não-neurologistas e não-gastroenterológicas. O desempenho dos ensaios pode melhorar com intervalos de referência mais baixos validados localmente, a adesão às normas orientadoras e a utilização numa população mais seleccionada.,
Correspondência: S O’Sullivan
Departamento de Neurologia, Cork University Hospital, Cortiça
e-Mail:
o Financiamento
S O’Sullivan recebeu apoio para participar de reuniões da Eisai Pharma, UCB, AbbVie, Lundbeck Pharma e Teva Pharma
- Cauza E, Maier-Dobersberger T, Polli C, Kaserer K, Kramer L, Ferenci P. de Triagem para a doença de Wilson em pacientes com doenças do fígado por séricos de ceruloplasmina. Journal of hepatology. 1997;27:358-62.Medici V, Rossaro L, Sturniolo GC. Doença de Wilson-uma abordagem prática ao diagnóstico, tratamento e acompanhamento., Digestive and liver disease: official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver. 2007;39:601-9.Roberts EA, Schilsky ML. Diagnóstico e tratamento da doença de Wilson: uma atualização. Hepatology (Baltimore, Md). 2008;47:2089-111.Stremmmel W, Meyerrose KW, Niederau c, Hefter H, Kreuzpaintner G, doença de Strohmeyer G. Wilson: apresentação clínica, tratamento e sobrevivência. Anais da medicina interna. 1991;115:720-6.Hellman NE, Gitlin JD. Metabolismo e função da ceruloplasmina. Revisão anual da nutrição., 2002;22:439-58.Scott J, Gollan JL, Samourian S, a doença de Sherlock S. Wilson, apresentando-se como hepatite crónica activa. Gastrenterologia. 1978;74:645-51.German JL, 3rd, Bearn AG. Efeito dos estrogénios no metabolismo do cobre na doença de Wilson. The Journal of clinical investigation. 1961;40:445-53.
- Mak CM, Lam CW, Tam S. precisão de diagnóstico da ceruloplasmina sérica na doença de Wilson: determinação da sensibilidade e especificidade por análise da curva ROC entre os indivíduos com genotipagem ATP7B. Química clínica. 2008;54:1356-62.,Ferenci P, Steindl-Munda P, Vogel W, Jessner W, Gschwantler M, Stauber R, Datz C, Hackl F, Wrba F, Bauer P, Lorenz O. Clinical gastroenterology and hepatology: The official clinical practice journal of the American Gastroenterological Association. 2005;3:811-8.
- Shah AB, Chernov eu, Zhang HT, Ross BM, Das K, Lutsenko S, Pavone L, Evgrafov O, Ivanova-Smolenskaya IA, Annerén G, Westermark K, Urrutia FH, Penchaszadeh GK, Sternlieb eu, Scheinberg IH, Gilliam TC, Petrukhin K., Identificação e análise de mutações no gene da doença de Wilson (ATP7B): frequências populacionais, correlação genótipo-fenótipo e análises funcionais. American journal of human genetics. 1997;61:317-28.Guidelines: Clinical Practice Guidelines: Wilson’s disease. Journal of hepatology. 2012;56:671-85.Gow PJ, Smallwood RA, Angus PW, Smith AL, Wall AJ, Sewell RB. Diagnóstico da doença de Wilson: uma experiência de mais de três décadas. Intestino. 2000;46:415-9.Tapper EB, Rahni DO, Arnaout R, Lai M. the overuse of serum ceruloplasmina measurement. The American journal of medicine., 2013;126:926.e1-5.Goldstein IM, Kaplan HB, Edelson HS, Weissmann G. Ceruloplasmin: an acute phase reactant that scavenges oxygen-derived free radicals. Anais da Academia de Ciências de Nova Iorque. 1982;389:368-79.Arredondo m, Nunez H, Lopez G, Pizarro F, Ayala M, Araya M. Influence of estrogens on copper indicators: in vivo and in vitro studies. Pesquisa de oligoelementos biológicos. 2010;134:252-64.Dufour JF, Kaplan MM. Muddying the water: Wilson’s disease challenges will not soon disease disappear. Gastrenterologia. 1997;113:348-50.
17. Schilsky ML, Ala A., Genetic testing for Wilson disease: availability and utility. Relatórios gastrenterológicos actuais. 2010;12:57-61.
Page 341
















Deixe uma resposta