US Pharm. 2010;35(5):36-41.
사이의 관계 당뇨병(DM)및 치매,부정 할 수없는 많은 연구 결론 DM 의 위험을 증가 하는 인지과 치매를 포함한 Alzheimer’s disease(AD).1-5DM 은 치매의 위험을 증가시킬뿐만 아니라 실제로 치매 발병 속도를 2~3 배로 증가시킵니다.,3 의 메커니즘이 장애가 완전히 이해되지 않지만,가설에서는 혈당,인슐린 저항성,산화적 스트레스,advanced glycation end products,염 공동으로 이끌어 인지 기능 장애 발생합니다.5 실제로,당뇨병은 많은 관련 합병증 때문에 1976 년에”특별한 종류의 가속 노화”로 묘사되었습니다.,5 명백한 중복 사 DM 와 치매가 주도하는 광고지 전적으로 신경학적 질환이 아니라,신경 내분비 장애를 가진 스틴 et al 는 용어를 만들 3 형 당뇨병을 설명하는 이는 하이브리드 질환입니다.,6
의 개요를 인슐린 저항성/내당능 장애
이상:모두 내당능 장애—으로 정의 플라즈마 포도당 140mg/dL199mg/dL 후 구두 포도당성 테스트와 장애인 금식당 정의로 금식하는 플라즈마 포도당의 100mg/dL125mg/dL—은 진단의 전당뇨(선구자 type2DM),같은 헤모글로빈 A1C5.7%6.4%.7prediabetes 의 병태 생리학은 126mg/dL 이상의 공복 혈당 또는 6 의 A1C 후에 진단되는 T2DM 의 병태 생리학과 동일합니다.,5%이상(확인을 위해 반복되는 테스트).7 에서 두 가지 조건이 모두 인슐린 저항성을 개발에 주변 조직,인슐린이 필요한 글귀를 포도당(즉,근육,간 및 fat)및 췌장은 강제로 공급하는 점점 더 많은 인슐린 이것을 극복하기 위해 저항이 있습니다.8 이 단계에서 환자는 자주 hyperinsulinemic;그러나 시간이 지남에 따라,췌장을 만날 수 없습니다의 요구 조직,및 인슐린을 생산하는 베타세포의 췌장 천천히 실패를 생산,점점 더 적은 사용자 인터페이스 개선.,8 충분한 인슐린이 없으면 혈당 농도가 상승하여 prediabetes 로 이어지고 prediabetes 환자의 최대 70%에서 T2DM 이 발생합니다.9 의 합병증 혈당은 많은 것을 포함한 위험의 증가 macrovascular complications(를 포함하여 심근경색,뇌혈관,사고 및 주변 혈관 질병)그리고 미세혈관병증(을 포함 신장병,신경,그리고 망막병증).7
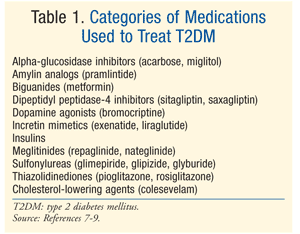
치료:DM 을 치료하기 위해 많은 치료법이 존재합니다., Prediabetes 와 T2DM 둘 다를 위한 처음 처리는 규정식,운동 및 체중 감소를 포함하는 생활양식 수정입니다.7 미국 당뇨병 협회(ADA)는 또한 당뇨병 발병 위험이 높은 당뇨병 전증 환자에서 메트포르민을 고려할 것을 권장합니다.7 메트포르민은 t2dm 에 대한 초기 약리학 요법으로 권장됩니다.7 종종 a1c<7%를 포함하여 ADA 혈당 목표를 달성하기 위해 추가적인 약리학 적 치료가 필요합니다.,7 는 수많은 클래스를 위한 약물의 T2DM(표 1)에이전트의 선택을 정규화하는 혈액 포도당에 따라 달라집트의 환자와 약물의 특정 요인입니다. 그것이 중요한 것은 많은 환자 T2DM 결국 외인이 필요한 인슐린을 달성하고 유지하기 위해 euglycemia 의로 베타-세포의 기능이 점진적으로는 떨어진다.
개요 광고
이상:광고가 가장 일반적인 형태의 치매에 노인의 60%를 차지,의 80%까지는 경우도 있습니다.,10ad 의 두 가지 조직 병리학 적 특징은 신경성 플라크와 신경 섬유 엉킴이다.11 개의 플라크는 불용성 베타-아밀로이드 단백질로 구성됩니다. 세포 내 인 엉킴은 인산화 된 타우 단백질로 구성됩니다. 타우 단백질은 미세 소관 조립에 중요하며,이 단백질이 비정상적으로 인산화되면 신경 기능이 중단됩니다. 신경 섬유 엉킴은 콜린성 뉴런에 가장 일반적으로 영향을 미칩니다.12 또한,주요 흥분성 신경 전달 물질 인 글루타메이트의 붕괴는 AD 의 병리학에 기여합니다., 광고 있 overactivation 의 글루타민산염,신호로 알려진 프로세스 excitotoxicity,지도하는 플라크 형성,hyperphosphorylation 타우의 단백질,셀 죽음입니다.12 에 요약,excitotoxicity 의 형성 neuritic 패과 엉킴을 방해 신경 전달 물질의 경로,그 결과에서 학습과 기억 장애 와 관련된 광고입니다.
치료:AD 에 대해 이용 가능한 FDA 승인 약리학 요법이 표 2 에 요약되어있다.,11,12 있는 동안은 아직 많은 것을 배운 것과 관련하여 치료는 치료 또는 변경하거나 병리의 광고,현재 사용되고 있는 치료법의 사용을 포함한 아세틸 억제제는 네 가지가 있고,N-methyl-d-아스파르트산염 수용체 길항근 memantine.

인슐린과 뇌
지만 그것은 필요한 운송 포도당으로 주변 조직,인슐린 나타나지 않을 필요한 전송의 포도당으로 두뇌에 대한 뇌 포도당 대사., 하는 동안 포도당을 운송하는 뇌에 의존하지 않는 인슐린,인슐린을 자체는 모 blood–brain barrier(BBB)인슐린에 의해 수용체 중재 운송 프로세스입니다.13 이 전송 메커니즘이 포화될 수 있다;시 장기간의 과잉 인슐린의 농도(시력과 신장 기능에 문제가)주변에,그와 같은 볼에 통풍 및 T2DM,이용 체 중재 전송 메커니즘 downregulates 함으로써 전송으로 인슐린의 뇌이고 뇌척수에 있습니다.,
외에 인슐린,insulin-like growth factor 유형 1(IGF-1)에 존재하는 두뇌와 필요한 일반적인 성장과 기능의 중추 신경계(CNS).14 인슐린과 IGF-1 수용체는 뉴런과 성상 세포(뇌의 뉴런을지지하는 데 도움이되는 CNS 의 별 모양의 세포)에 뇌 전체에 위치하고 있습니다. 학습과 기억에 결정적인 뇌의 두 영역 인 해마와 시상 하부는 고농도의 인슐린 수용체를 포함합니다.5 쥐에서 뇌내 인슐린 투여는 기억력을 향상시키는 것으로 나타났습니다.,15 또한,인간에서의 비강 내 인슐린 투여는 기억 성능을 증가시키는 것으로 밝혀졌다.16 앞에서 언급한 것처럼 인슐린이 필요하지 않습에 대한 뇌 포도당 대사;그러나,있을 수 있습니다 특정한 지역에서 뇌는 인슐린 대사 프로세스를 포함하는 포도당입니다. 쥐의 연구,인슐린을 좌우하기 위하여 보였 포도당 이용 시상 하부에서 locus coeruleus,두 가지 영역에 중요한 학습니다.,17 또한 학습을 촉진하는 것으로 나타났다의 증가 식 CNS 인슐린 수용체 선도,postulation 는 현재 상태 및 활동에 있는 인슐린의 뇌에 기여하는 과정에서 중추적인 역할을 담당할 학습니다. 인슐린에 기여할 수 있습니다 또한 변조의 중추 신경전달물질,특히 아세틸콜린과 노르에피네프린,모두의는 중요한 정상인지 및 뇌의 건강이다.,18
인슐린 저항성과 치매
개요:가 많은에서 결함 인슐린 신호의 두뇌에서 광고를 환자의 감소 포도당 활용 및 에너지 대사가 있습니다.6,19T2DM 은 말초 인슐린 저항성과 관련이 있으므로 ad 는 뇌 인슐린 저항성과 관련이 있습니다.20Ad 초기에 인슐린 저항성의 징후 인 뇌에 부적절한 인슐린 흡수 및 신호가있는 것으로 보입니다.5,19,21,22 증가 된 인슐린 수용체는 인슐린 저항성에 대한 보상으로 ad 환자의 뇌에서 나타났습니다.,21
전반적으로,인슐린 신호 전달에있어이 손상은 AD 에서 많은 다운 스트림 효과를 갖는다. 한 가지 이론은 CNS 에서 인슐린의 농도가 낮 으면 아세틸 콜린 수치와 대뇌 혈류가 감소한다는 것입니다.13 또한,인슐린 농도의 변화는 베타-아밀로이드 및 타우 단백질 형성을 촉진 할 수있다.2 뇌에서 인슐린 분해 효소(IDE)는 베타-아밀로이드 단백질의 분해 및 클리어런스에 관여합니다.21 높은 수준의 인슐린은 IDE 를 억제하고 베타-아밀로이드 클리어런스의 감소로 이어져 베타-아밀로이드의 뇌 침착을 증가시킬 수 있습니다.,5,19,21
최근 지질의 가족 인 세라마이드는 인슐린 저항성과 치매에서 잠재적 인 역할에 대한 관심을 명령했습니다.23,24 세라마이드는 비만,T2DM 및 AD 에서 흔히 볼 수있는 염증의 존재 하에서 생성됩니다.24 세라마이드가 BBB 를 쉽게 교차하기 때문에 노출은 손상된 에너지 대사 및 인슐린 유전자 발현의 변화를 유발하여 인슐린 저항성에 기여합니다.23,24 이것은 현재 활동 지역의 관심과 연구자들은 보여주는 억제 세라마이드 합성 방 비만 중재는 인슐린 저항이 있습니다.,24
비강 내 인슐린:이전에 언급했듯이 비강 내 인슐린 투여는 인간의 기억 성능을 향상시킵니다.16 비강 내 인슐린에 대한 여러 연구가 수행되었습니다. 의 관리 시 20 대의 intranasal 인슐린 매일 두 번하여 인체,레거 et al 는 위약에 비해,그룹의 치료로 인슐린을 유지 더 많은 정보와 구두 보여 개선의 관심과 기능 상태입니다.,25 이러한 연구진은 주목하는 금식하는 플라즈마 포도당과 인슐린을 변경하지 않았으로 intranasal 인슐린을 사용하는 것을 나타내는 비강 관리 제공하는 직접적인 인슐린스 CNS 지 않고 주변 장치는 효과.25,26
PPAR-감마 Agonists:광범위하게 공부한 치료의 주변 인슐린 저항,thiazolidinediones rosiglitazone 에와 pioglitazone 조사가 이루어지고 있다 위에서 자신의 역할을 치료하는 광고입니다. 티아 졸리 딘 디온은 퍼 옥시 좀 증식 자-활성화 수용체(PPAR)–감마 작용제이다., PPAR-감마는 포도당 및 지질 대사에 관여하며 ad 에 알려진 기여자 인 염증을 조절합니다.22,27Thiazolidinediones 은 인슐린 sensitizers,을 줄이기 위해 노력하고 인슐린 저항성,그들도 나타나 염증을 감소시키.21,26 여러 위약 대조 시험에서 로시글리타존으로 치료받은 환자는 기억력과인지 기능이 향상되었음을 보여주었습니다.21,22,28 피오글리타존에 대한 작은 연구 만이 수행되었지만,이 약물은 또한 기억력과인지의 개선과 관련이 있습니다.,22 피오글리타존과 로시글리타존은 BBB 투과성이 좋지 않지만,이들 약제 각각은 경구 투여 후 뇌에서 문서화되었다.22 지만 이러한 약물에 역할을 할 수 있습니다 예방 또는 치료의 광고,그들은 현재 FDA 승인 환자를 위한 광고,그리고 그들의 장점과 위험성이어야 한 철저하게 고려한다.유산소 운동:아마도 인슐린 저항성을 줄이는 가장 효과적이고 가장 간과되는 방법은 신체 활동입니다., 비만은 인슐린 저항성,당뇨병,치매 및 AD 의 위험 증가와 관련이 있습니다.29,30 운동은 인슐린 감수성을 향상시키고 말초 인슐린 수치를 낮춘다.26,31 체중과 독립적 인 신체 활동은 AD 의 낮은 위험과 관련되어있어 유일하게 입증 된 신경 보호 요법입니다.29-31 가능한 메커니즘의 이 신경은 운동을 촉진하의 클리어런스 베타-아밀로이드 단백질 및 증가 brain-derived neurotrophic factor,성장에 중요한 요소인지 및 신경 생존하는 감소에서 광고입니다.,32
약사의 역할
약사는 새로운 치료법에 대해 환자를 교육하는 데 필수적인 역할을합니다. 제 3 형 당뇨병은 그러한 상태 중 하나입니다. 는 동안 많은 것을 배운 것에 대해 이 잠재적인 새로운 사이의 링크를 당뇨병과 장애인지,공중이 요구 될 것입니다 그들의 건강을 배려 공급자는 의견입니다. 또한,많은 환자가 당뇨병을 가진 것이 학습에 관심있는 더 많은 것이 차례로 그들의 약사에 대한 정보입니다., 따라서,약사하는 것에 대한 현재의 이해를 조건으로 환자들하고 또한 조언에 대해 그들의 전략을 줄일 수 있습니다 그들의 위험을 주어,그들의 개인적인 comorbidities.
결론
집중적인 연구를 진행하려는 시도에서 더 나은 특성을 3 형 당뇨병과 개발을 예방 및 치료 전략이 있습니다. 현재까지 DM 환자의인지 기능 저하 또는 AD 예방에 입증 된 효능을 가진 특정 치료법은 없습니다., 따라서 DM 환자의인지 장애 관리는 혈당 조절 및 심혈관 위험 인자에 특별한주의를 기울여 DM 이없는 환자의 경우와 동일합니다. 이것은 이미 DM 관련 합병증을 예방하는 데 필수적인 것과 동일한 접근법입니다. 일부 환자 그룹은인지 장애 위험이 증가하는 것으로 보이지만 dm 환자의 대다수는 잘 정의 된 임상 적 연관성이 없습니다., 지 않지만 특정 처리 옵션을 사용할 수 있는,현재의 논리적인 접근 방식은 혈당을 달성하 제어하고 신중하게 관리하는 심혈관계 위험 요소와 같은 혈과 고혈압이라고 합니다.피>1. Stewart R,Liolitsa D. 제 2 형 당뇨병,인지 장애 및 치매. 디아베 메드.
2 입니다. Xu WL,von Strauss E,Qiu CX,et al. 통제되지 않은 당뇨병은 알츠하이머 병의 위험을 증가시킵니다:인구 기반 코호트 연구. 당뇨병 환자. 2009;52:1031-1039.
3. Arvanitakis Z,윌슨 RS,베넷 다. 노인의 당뇨병,치매 및인지 기능., J Nutr 건강 노화. 2006;10:287-291.
4. Jacobson AM,Musen G,Ryan CM,et al. 당뇨병과 그 치료법이인지 기능에 미치는 장기적인 영향. N Engl J 의대. 2007;356:1842–1852.
5. 휘트머 라. 제 2 형 당뇨병 및인지 장애 및 치매의 위험. Curr Neurol Neurosci Rep.2007;7:373-380.
6. Steen E,Terry BM,Rivera EJ,et al. 알츠하이머 병에서 손상된 인슐린 및 인슐린 유사 성장 인자 발현 및 신호 전달 메커니즘-이 3 형 당뇨병입니까? J Alzheimers Dis. 2005;7:63-80.
7. 미국 당뇨병 협회. 당뇨병의 의료 기준-2010., 당뇨병 관리.
8. Triplitt Cl,Reasner CA,Isley WL. 당뇨병. In:DiPiro JT,Talbert RL,Yee GC,et al,eds. 약물 요법 원리&연습. 7 번째 에드. 뉴욕,뉴욕:맥그로 힐 메디컬;2008:1205-1241.
9. Nathan DM,Buse JB,Davidson MD,et al. 의 의료 관리 혈당 2 형 당뇨병에서:합의를 위한 알고리즘을 개시와의 조정을 요법:합의 문은 미국의 당뇨병 협회 및 유럽 연합에 대한 연구의 당뇨병이 있습니다. 당뇨병 관리.10. Hebert LE,Scherr PA,Bienias JL,외., 미국 인구의 알츠하이머 병:2000 년 인구 조사를 사용한 유병률 추정치. 아치 뉴롤. 2003;60:1119-1122.
11. 커밍스 제이 알츠하이머 병. N Engl J 의대. 2004;351:56-67.
12. Slattum PW,Swerdlow RH,힐 오전. 알츠하이머 병. In:DiPiro JT,Talbert RL,Yee GC,et al,eds. 약물 요법 원리&연습. 7 번째 에드. 뉴욕,뉴욕:맥그로 힐 메디컬;2008:1051-1065.13. 공예 S,왓슨 GS. 인슐린 및 신경 퇴행성 질환:공유 및 특정 메커니즘. 란셋 뉴롤. 2004;3:169-178.
14. 드 라 몬테 SM,완드 주니어., 중추 신경계의 인슐린 및 인슐린 유사 성장 인자 발현,신호 전달 및 오작동에 대한 검토:알츠하이머 병과의 관련성. J Alzheimers Dis. 2005;7:45-61.
15. 파크 CR,실리 RJ,공예 S,우즈 SC. 뇌내 인슐린은 수동 회피 작업에서 기억력을 향상시킵니다. Physiol Behav. 2000;68:509-514.
16. Fehm HL,Perras B,Smolnik R,et al. 인간의 신경 펩타이드 경로 조작:신경 약리학에 대한 새로운 접근법? Eur J Pharmacol. 2000;405:43-54.17. 자오 WQ,Alkon DL. 학습과 기억에서 인슐린과 인슐린 수용체의 역할., 몰 세포 내분비. 2001;177:125-134.
18. Kopf S,Baratti C. 쥐에서 습관화 반응의 유지에 대한 인슐린의 posttraining 투여의 효과:중심 콜린성 메커니즘의 참여. Neurobiol 은 Mem 을 배웁니다.19. Revill P,Moral MA,Prous JR.인슐린 신호 전달 장애 및 알츠하이머 병의 병인. 오늘 마약(Barc). 2006;42:785-790.20. Moroz N,통 M,Longato L,외. 실험 비만 및 제 2 형 당뇨병에서 제한된 알츠하이머 형 신경 퇴행. J Alzheimers Dis. 2008;15:29-44.21. 하안 MN., 치료 통찰력:제 2 형 당뇨병 및 후기 발병 알츠하이머 병의 위험. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G,Jiang Q,Madrekar S,et al. 알츠하이머 병의 치료를위한 치료제로서의 PPARgamma 작용제. 신경 치료제. 2008;5:481-489.23. Lyn-Cook LE,Lawton M,Tong M,et al. 간 세라마이드는 제 2 형 당뇨병 및 비 알콜 성 지방 간염에서 뇌 인슐린 저항성 및 신경 퇴행을 매개 할 수 있습니다. J Alzheimers Dis.24. 통 M,드 라 몬테 SM. 세라마이드 매개 신경 퇴행의 메커니즘. J Alzheimers Dis.25., Reger 엄마,왓슨 GS,녹색 PS. 비강 내 인슐린은인지를 향상시키고 초기 AD 에서 베타-아밀로이드를 조절합니다. 신경학. 2008;70:440-448.26. Craft S. 인슐린 저항성 증후군 및 알츠하이머 병:기억,아밀로이드 및 염증에 대한 연령 및 비만 관련 효과. 뉴로 비올 노화. 2005;26(suppl1):65-69.
27. 장 Q,Heneka M,Landreth GE. 알츠하이머 병에서 peroxisome proliferator-activated receptor-gamma(Ppargamma)의 역할:치료 적 의미. CNS 약물. 2008;22:1-14.28. Watson GS,Cholerton BA,Reger MA,et al., 로시글리타존으로 치료하는 동안 초기 알츠하이머 병 및 기억 상실 성 경증인지 장애 환자에서 보존 된인지:예비 연구. Am J 노인 정신과. 2005;13:950-958.29. Luchsinger JA,Mayeux R.Adiposity 및 알츠하이머 병. Curr Alzheimer Res.2007;4:127-134.30. 휘트머 라. 지방과 치매의 역학. Curr Alzheimer Res.2007;4:117-122.31. Watson GS,Craft S. 알츠하이머 병의 병인에서 인슐린 저항성의 역할:치료에 대한 시사점. CNS 약물. 2003;17:27-45.32. 콜 GM,Frautschy 사., 뇌 노화와 알츠하이머 병에서 인슐린과 신경 영양 인자 신호의 역할. 경험치 제론톨. 2007;42:10-21.피>
















답글 남기기