소개
Chloroplasts 나타내는 구조적인 기능의 식물 세포 및 지원은 식물의 생존을 통해 그들의 주요 대사와 높은 수준의 함수(이프라이어스 교회 및 Tilney-셋,1978;숭어,1988;López-Juez 및 Pyke,2005). 식물의 식물 성장 동안 잎 세포는 크기와 모양과 관련하여 매우 균질 한 엽록체 집단을 포함합니다., 수 chloroplasts 셀당은 달성으로 이분의 기존 세포 기관 및 파티션으로 두 딸 세포하는 동안 세포분열(Birky,1983;Possingham 및 로렌스,1983). 따라서,주어진 세포 유형에서 엽록체 수의 조절은 엽록체의 세포 기능 및 유전 상속에 결정적이다.
식물 세포에서 엽록체 수 결정의 본질을 조사하기 위해 대표적인 종의 잎 중배엽 세포가 중요한 역할을했다., 이 세포들은 생리 학적으로 광합성에 중요하며 높은 수준의 구조적 및 기능적 균질성을 보여줍니다. 분리 된 조직과 세포의 초기 체계적인 관찰 분석(Boasson and Laetsch,1969;Possingham and Saurer,1969;Boffey et al.,1979;Lamppa 등.,,1980;토마스,로즈,1983;Pyke 및 거머리,1991)제공하는 훨씬에 대한 유용한 정보를 엽록체 수를 결정을 포함하여는 개념 chloroplasts(plastids)합성되지 않습 de novo 지에 의하여 복제 부문 그리고 관찰하는 잎 mesophyll 엽록체 수은 민감한 다양한 환경 및 플랜트-생 요소입니다. 과 관련하여 후반에,시금치,빛에 긍정적인 영향 엽록체 부문하는 동안 잎 disc 문화와 비교해 어둡거나 어두운 조건(Possingham 및 로렌스,1983)., 밀의 첫 번째 잎에서 세포 부피는 엽록체 증식과 양의 상관 관계가있다(Ellis and Leech,1985;Pyke and Leech,1987). Arabidopsis,유전자 배경 영향 엽록체 확산에 평균 엽록체 수를 셀당에서 첫 번째 나뭇잎은 121 할레 erecta(Ler)천억달러 생태형 83 에 Wassilewskija(Ws)천억달러 생태형(Pyke 및 거머리,1994;Pyke et al., 1994)., 리프 mesophyll 세포 기여를 이해하고 유전자제의 엽록체 부;예를 들어,심사에 장애가 있는 돌연변이 엽록체 확산과 특성화는 유전자의 기능에 관련된 엽록체가 공개 이상 20 유전자 인코딩을 엽록체 부 기계류 구성 요소 또는 엽록체 규정 요인(가오와 가오,2011;Miyagishima et al. 2011 년;Basak 및 Møller,2013 년;Osteryoung 및 Pyke,2014;Li et al., 2017).
대조적으로,비 중배엽 세포에서 엽록체의 복제에 관한 연구(예:,,잎 표피의 포장 세포;Itoh et al.,2018)은 부족합니다. 최근에는 엽록체 분열의 조절이 잎 조직간에 다른 것으로보고되었다(Fujiwara et al.,2018;이토 외. 자세한 메커니즘은 아직 알려지지 않았지만 2018). 또한,담배에서 현탁 배양 된 BY-2 세포 및 잎 중배엽 원형질체를 분석하고 Arabidopsis 에서 정점 메리 스템 및 잎 원형질 세포를 쏘는 동안(Nebenführ et al.,2000;시한 외.,,2004;Seguí-Simarro and Staehelin,2009)은 주요 통찰력을 제공했으며,식물에서 엽록체(plastid)분할이 어떻게 조절되는지는 여전히 불분명하다. 따라서,상당한 노력에도 불구하고,근본적인 질문에서 엽록체 연구 남아 같은(i)는 방법은 엽록체 수를 셀당 조정에 식물 조직 및(ii)는 방법은 엽록체 분할에서 규제 세포분열.,
역사의 연구에서 가드 셀 엽록체번호
Stomatal GCs 에서 촬영 표 피 일반적으로 포함 엽록체 및 제어 가스교환 잎 mesophyll 고기(Sachs,1875 년;타이즈 et al.,2015;그림 1A 참조). 잎의 gc 엽록체 수에 대한 최초의 조사는 1 세기 전에 자연적으로 자란 Drosera 식물에서 수행되었다(Macfarlane,1898)., 이 연구는,다음과 같은 다른 식물과 셀,구조적 특징 GC 엽록체 수를 셀당에서 상 하이브리드에서 파생된 간 끈끈이 filiformis 고 끈끈이 인터었 중간 사이에 두 종는 것을 의미,GC 엽록체가 될 수 있을 결정하는 데 사용되는 유전자의 식물입니다. 중요한 관찰 이후에는 차이점에서 GC 엽록체 가운 식물 종(Sakisaka,1929 년)및 상대적으로 안정적이 엽록체에서 번호를 GCs 에 잎 표피의 뽕나무(뽕나무 속 spp.,;Hamada 와 Baba,1930)및 여러 Brassica 종의 성숙한 잎(Iura,1934). 또한,분석 autopolyploid 사탕무(Beta vulgaris)식물 밝혔 GC 엽록체 수에서 나뭇잎은 긍정적으로 상호 연관 원자력 배수성 수준의 식물(모치즈키고 Sueoka,1955). 더 심층적이고 포괄적인 분석은 다음을 사용하여 실시 다양한 식물 샘플 관계를 조사의 엽록체 수와 stomatal 크기와 배수성(예를 들어,Frandsen,1968)., 에서 이러한 분석,엽록체 계산에 stomatal(GC pair)수준은 자주 채택되는 제외의 효과 편향 엽록체류 짝 GCs(예를들면,모치즈키고 Sueoka,1955 년;Frandsen,1968),을 드러내는 평균 GC 엽록체 수에서 나뭇잎이나 자엽에 약 80 종,개 또는 하이브리드에서 원거리 2.8 을 40.0 에 diploids(2×)and5.0 73.5 에 tetraploids(4×). 또한,식물에서의 전체 게놈 중복 사건(즉,1×~2×,2×~4×등).)는 약 1 을 일으켰습니다.,높은 충실도로 GC 엽록체 수의 7 배 증가(Butterfass,1973 에서 검토). 이러한 결과는 권장 조사로 배수성 수준에서 다양한 조직에 식물을 통해 얻은 조직 문화,교차,또는 자연 재배 조합에서,화학적으로(예를 들어,콜치신)또는 방사선 치료(예를들면,제이콥스와 Yoder,1989;Singsit 및 Veilleux,1991;진 Rotino,1995)., 동 GC 엽록체 수에서 공부되었 stomatal 생물학(로손,2009 년)및 세포학을 이해하는 엽록체 곱셈(Butterfass,1979,아래 참조)에,그것은 주로 제공하는 믿을 수 있는 편리한 마커의 검출을 위한 하이브리드,종,개와 추정의 배수성 수준의 대상 식물 조직.
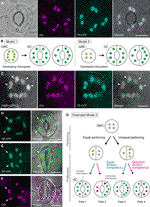
림 1 단순화된 모델과 현미경에 대한 증거를 제어의 엽록체에서 수시켜줍 세포(GCs)., (A)시안 형광 단백질(CFP;TP-CFP)과의 이동 펩타이드(TP)의 stoma-표적화 된 융합을 발현하는 Arabidopsis 잎 블레이드의 abaxial 표피에서 전형적인 stoma(GC 쌍). (B)두 가지 모델의 엽록체 수를 결정에 GCs 포함하는 중 엽록체 분할(model1)또는 모두 엽록체 확산 및 분델(2)동안 GC 개발이 가드에서 어머니가 세포(GMCs). (C)녹색 형광 단백질(GFP;FtsZ1-GFP)에 융합 된 Tp-CFP 및 FtsZ1 을 발현하는 Arabidopsis 잎 잎자루의 adaxial 표피에서 GC 쌍., (D-F)황색 형광 단백질(YFP;TP-YFP)에 융합 된 TP 의 발현(D,E)또는(F)없는 Arabidopsis 잎 블레이드의 축 표피에서 GC 쌍. (F)엽록소자가 형광체(Chl)를 엽록체 마커로 사용 하였다., (G)확장 모델이 2 대표의 참여 동일하고 불평등 엽록체 분할은 다음과 같은 GMC 부문과 이후 부문의 GC 엽록체와 동일(블루 라인)또는 선택(레드 라인)부문 역량을 결정은 네 가지 유형의 엽록체 수를 결정(운명 1-4)중 늦은 stomatal 개발의 Arabidopsis 잎입니다. (A,C–F)Epifluorescence 현미경은 이전에 기술 된 바와 같이 식물 재료를 사용하여 Olympus IX71 반전 현미경으로 수행되었다(Fujiwara et al.,2017,후지와라 외., 2018)., 엽록소,CFP,GFP 및 YFP 의 형광 신호는 각각 마젠타 색,시안 색,녹색(병합 된 이미지에서만)및 녹색으로 의사 색입니다. 패널의 표시는 다음과 같습니다:화살촉,FtsZ1 링;화살표,확대 된 GC 엽록체;점선,세포 모양. 스케일 바=10μm.
유틸리티의 잎을 가드에 대한 세포의 분석을 엽록체 숫자 컨트롤
리프 mesophyll 세포었으로 고용되는 기본 모델에 대해 분석의 엽록체 번호입니다., 는 동안 그들은 이점에 대한 영향에 관한 연구 환경 조건에서 엽록체 분할(예를 들어,빛-시토키닌 신호;Boasson 및 Laetsch,1969;Possingham 및 로렌스,1983;오카자키 et al.,2009;치앙 외.,2012),그들은 어떤면에서 제한적이다. 첫째,잎 중배엽 세포는 크기와 모양이 다양하며 잎 깊숙히 분포되어있어 손상되지 않은 조직을 조작하기가 어렵습니다., 둘째,민감성의 잎 mesophyll 엽록체 증식하는 환경적 스트레스와 식물 성장 조건을 방지할 수 있 신뢰할 수 있는 사이의 비교는 학문이다. Arabidopsis Columbia(Col)ecotype 에서 세포 당 잎 mesophyll 엽록체 수는 76(Kinsman and Pyke,1998),80-100(Stokes et al. 2000 년),70(Tirlapur 및 König,2001),41(Yoder et al.,2007),40-60(오카자키 외.,2009),30-40(Kawade et al., 2013)., 또한,그것은 거의 불가능을 평가에 기여의 엽록체 분할 최종 엽록체당 수 mesophyll 셀 중 잎 개발,하지만 이것은 생각이에 의해 결정되는 사이의 균형 속도의 세포분열 및 평가의 엽록체 division. 식물 잎 세포에서 엽록체 수 조절의 메커니즘을 밝히기 위해서는 위의 문제를 극복하는 모델 시스템이 필요합니다.
Stomatal GCs(그림 1A 참조)는 엽록체 수 제어의 메커니즘을 이해하기위한 모델 시스템의 특성을 나타낸다., Gc 높은 균일한 크기와 모양에서 내에서 조직 및 그들의 흩어져있지만 고밀도 분포에서 가장 바깥쪽의 계층 촬영을 용이하게 그들의 탐지에 의해 가볍고 형광 현미경. Gc 도에서 파생된 protodermal 세포에서 촬영하는 꼭대기 분열 조직 또는 배아에서 상피세포,그리고 자신의 발달 순서를 통해 meristemoids(a stomatal 선구자로 meristematic 활동)그리고 경비는 어머니의 셀(GMCs;의 선구자 GC 쌍)에 설립된 세부(조 및 자루,1999;Nadeau 및 자루,2002;Kalve et al., 2014)., 후기 stomatal 발달은 cytokinesis 전후의 엽록체 분포 및 분할의 평가를 가능하게하는 대칭 GMC 분열의 단일 라운드를 포함한다. 실용적인 실험의 관점에서,잎 GCs 는 현미경 검사에 적합합니다. 이전에 Sinapis alba 의 leaf GCs 에서 세포 당 엽록체 수는 leaf mesophyll 세포(Wild and Wolf,1980)에서보다 다른 빛 조건에 의해 덜 영향을 받았다는 것을 보여 주었다., 또한,잎 잎자루에서 gc 엽록체 수의 차이는 3 개의 Arabidopsis ecotypes Col,Ler 및 Ws 중에서 상대적으로 미미하다(Fujiwara et al., 2018). 또한,잎 mesophyll,포장 및 trichome 세포의 발달에 영향을 미치는 endoreduplication 은 Arabidopsis leaf GCs 에서 검출되지 않았다(Melaragno et al.,1993),이는 세포의 2C 수준에서 엽록체 수 데이터의 해석을 보장 할 것이다., 함께,이 보고서는 잎 GCs 가 잠재적으로 특정 세포 계보에서 엽록체 수 역학의 체계적인 분석을위한 훌륭한 모델임을 시사한다.
Arabidopsis 잎드 셀 공부를 위한 모델로 제어의 엽록체번호
의 역사에서 GC 엽록체 연구,엽록체 계산에 stomatal(GC pair)레벨은 제공되는 동일하게 중요한 역할을 결정하는 엽록체 수로 계산에는 개인 GC 수준입니다. 두 방법 모두 동일한 평균 엽록체 수를 생성합니다(Butterfass,1973)., 을 때 변형에서 엽록체에서 유통 짝 GCs 및 그것의 근본적인 메커니즘의 대상 초점,자세한 정보의 엽록체에서 개인적인 세포 수준,즉,크기,모양,그리고 세포내 지역화가 필수적입니다. GMC–GC 분화 동안 엽록체(plastid)증식은 이전에 여러 식물 종에서 조사되었다(Butterfass,1973,Butterfass1979)., 이러한 연구 제안된 두 가지 모델을 결정하기 위한 터미널 엽록체에서 번호를 GCs 에서 다른 종의 식물(Figure1B):나(model1;사탕무)는 엽록체 분할에서 GMC 부문,및 다른 포함하지만 엽록체 분할 또한 엽록체 증식하는 동안 GC 개발.
시대에서의 분자 유전학,유전체학,세포 이미징,그리고 다른 학제 분석 많은 가능성에 대한 추가 특성의 엽록체 분 메커니즘이 있습니다., Arabidopsis leaf gcs 는 이러한 목적을위한 최상의 모델 시스템 중 하나 일 수 있습니다. 몇몇 연구는 Arabidopsis 의 잎 또는 자엽에서 gc 엽록체 수를 조사했다(Hoffmann,1968;Pyke and Leech,1994;Pyke et al.,1994;로버트슨 외.,1995;Keech 외.,2007;첸 외.,2009;유 외.,2009;히가키 외.,2012;후지와라 외., 2018). 이 GCs 는 평균 3.5 에서 5.5 에 이르는 겸손한 수의 엽록체를 나타낸다. 현재까지,위 발달 동안 엽록체(plastid)수의 변화를 조사한 연구는 없다., 그러나,stomatal 발달 분석에서 현미경 적 증거(예를 들어,Zhao and Sack,1999;Hachez et al. 2011 년)와 우리의 예비적인 관찰을 나타내는 GMCs 포함할 수 있는 작은 숫자를 개발의 엽록체보다 GCs 는 엽록체 확산 중 발생할 수 있 GC 차별화입니다. 이를 시험하기 위해,녹색 형광 단백질(ftsz1-GFP)에 융합 된 프로브 FtsZ1 로 gcs 에서 엽록체 분할 기계의 형성을 모니터링 하였다(Fujiwara et al., 2008)., 유모 및 FtsZ1 고리를 시각화하기 위해 transit peptide(TP)-fused CFP 및 FtsZ1-GFP 를 동시에 발현하는 형질 전환 라인을 각각 epifluorescence microscopy 에 의해 검사 하였다(Fujiwara et al., 2017). 확장 잎 잎자루(4 주 된 묘목의 다섯 번째 잎)가 사용되었습니다. 그 결과,대칭 적으로 수축하는 엽록체를 갖는 GCs 가 검출되었다(그림 1C). 이 엽록체는 잎 메조 필 및 포장 세포에서 내부 엔벨로프 막의 간질 표면에 엽록체 분할 고리 인 FtsZ1 고리를 형성했다(Vitha et al.,2001;후지와라 외.,,2008),적도 수축 사이트에서. Arabidopsis 잎 발달에있는 stomatal patterning 와 일치하십시오(Donnelly et al.,1999;Andriankaja 외.,2012),분열 엽록체는 잎 확장의 초기 단계뿐만 아니라 후기에 검출되었다. 따라서 모델 2 는 Arabidopsis leaf gcs 에 가장 적합 할 가능성이 큽니다.
사이의 관계를 엽록체 확산과 확장에서 Arabidopsis 잎드 셀
또한,예상치 못한 형의 GC 엽록체 morphogenesis 에서 관찰되었다가 성숙 GCs(그림 1D,E)., 때 표피의 껍질이 완전히 확장 잎(세 번째 넷째 잎 블레이드의 4-week-old 모종)에서 TP-융합된 형광 노란색 단백질(YFP)적인 현미경으로 특징(FL6-5 줄;후지와라 et al.,2018),일부 위장은 GC 쌍에서 불평등 한 엽록체 분포 패턴을 보였으 나,대부분의 잎 위장은 동일하거나 유사한 엽록체 분포 패턴을 보였다(Robertson et al.,1995;후지와라 외., 2018)., 내 GC 쌍의 기공,크기의 엽록체에서 GC 포함하는 작은 숫자의 엽록체보에서 다른 Gc 에서 쌍을 포함하는 더 큰 숫자의 엽록체(그림 1D,E). 이러한 방식으로,GCs 는 아마도 세포 성장 동안 세포 당 총 엽록체 부피를 일정한 수준으로 유지한다. 확대 된 엽록체는 말단 표현형을 나타내며 더 이상 확장 된 잎에서 분열 할 수 없었다. 이러한 결과는 stroma 라벨링을위한 tp-융합 형광 단백질의 발현에 관계없이 여러 독립적 인 실험에서 확인되었다(그림 1F).,
이 GC 엽록체 형은 해석상의 메커니즘을 엽록체 확장,는 잘 설명되어에 잎 mesophyll 세포 불완전한 제어에서 엽록체 부(Pyke 및 거머리,1994;Pyke et al., 1994). 날짜,하나의 연구(Ellis 및 거머리,1985)보도했다는 부정적인 사이의 상관 관계를 엽록체 수와 엽록체 크기에 잎 mesophyll 세포의 밀는 반면,많은 연구 보고 긍정적인 사이의 상관 관계를 세포 볼륨 및 엽록체에서 번호를 정상적인 잎 mesophyll 세포(거머리와 Pyke,1988;Pyke,1997)., 반면 gc 엽록체 수의 불균형은 저주파수에서 발생한다(Fujiwara et al.,2018),엽록체에는 질 GC 쌍을 나타내는 부동 엽록체 분할을 실행할 수 있 차이 엽록체의 성장이 야생형 리프 셀 Arabidopsis 에도 불구하고,대칭입니다.
gcs 에서의 엽록체 보상 효과는 잎 중배엽 세포보다 덜 엄격 할 수있다., Gc 수 있습을 견딜 수 있 부족 또는 완전한 손실이 전체의 엽록체에 볼륨 셀당에서 심하게 손상된 엽록체 부 돌연변이와 같은 Arabidopsis arc6 및 atminE1 와 토마토 suffulta 는 반면,많은 돌연변이 GCs 감소를 보였 엽록체 수를 확대 엽록체 크기는 마찬가지로 리프 mesophyll 세포(로버트슨 et al.,1995;Forth and Pyke,2006;Chen et al.,2009;후지와라 외., 2018)., 에서 늦은 엽록체 부 돌연변이,arc5,감소에서 GC 엽록체 수와 관련이 있었다 크게 증가에서 엽록체 크기와는 달리,잎 mesophyll 세포(Pyke 및 거머리,1994). Mesophyll 세포에서보다 GCs 에서 엽록체 확장의 정도가 낮다(Pyke and Leech,1994;Barton et al.,2016),그리고 gcs 사이의 엽록체 확장의 변화는 GC 당 총 엽록체 부피의 그러한 넓은 허용 범위를 뒷받침 할 수있다., 또한,gmc–GC 분화 동안 엽록체 분열의 타이밍은 말단 GC 엽록체 표현형에 유의미한 영향을 미칠 수있다. 비록 더 상세한 특성화 필요 이 문제를 해결하기 위해,그것은 그럴 것 같 Arabidopsis 잎 GCs 을 나타내는 시스템을 조사를 놓치지 않도록 하는 측면의 엽록체 수를 제어하는 식물 세포에서.,
작동하는 모델에 대한 엽록체 수를 결정 Arabidopsis 잎드 셀
기초 위에서,우리는 제안 작동하는 모델(모델 확장 2)분석에 대한의 엽록체에서 번호를 GCs(그림 1G). GC 당 최종 엽록체 수는 gmc 분할에서의 엽록체 분할 및 gcs 에서의 엽록체 확산에 의해 결정된다. GMC 분할 동안,엽록체는 동일하거나 불평등 한 분할을 겪을 수있다. 엽록체 증식 동안,GC 엽록체는 균등(청색 선)또는 선택적(마젠타 선)분할 역량으로 증식 할 것이다., 예를 들면,똑같이 분할된 엽록체 소유하는 상당 부문 역량,동일 엽록체에는 숫자에 발생합니다 GC 쌍(Fate1)입니다. 불평등하게 분할 된 엽록체가 동등한 분할 역량을 보유한다면,엽록체는 GC 쌍(Fate3)내에서 동일한 속도로 증가 할 것이다. 선택적 엽록체 분열이 GCs 에서 발생하면 GC 쌍에서 엽록체 수의 균형은 GMC 분열 후에 변할 것이다(운명 2 와 4)., 그것은 현재 어려운 찾을 수 대한 지원이”선택적 엽록체 부문,”하면 운명 1,4 실제로에서 우세 Gc,그들은 수를 보유 메커니즘을 제어하는 총 엽록체 볼륨 셀당에서와 같이,리프 mesophyll 세포입니다. 이 모델은 두 가지 문제를 제기합니다:(i)gc 엽록체가 딸 세포로 적절하게 분할되고 어떻게 분할합니까? 그리고(ii)GC 엽록체의 분열 역량은 조정 적으로 규제됩니까?,
관련 문제가(i)지,엽록체 상속가 발생합 랜덤으로 배포의 여러 개의 엽록체에는 세포질 또는 긍정적인 엽록체 분 메커니즘(s)되었고 서 있는 관심사(Butterfass,1969;Birky,1983;Hennis 및 Birky,1984;Nebenführ,2007;쉬 한 et al., 2016). 글,Arabidopsis arc6,잎 또는 떡잎 GCs 로 세 개의 엽록체에서 엽록체-불충분한 GCs,비 광합성 plastids 여전히 존재하에서 기공을하고 길쭉한 형태(로버트슨 et al.,1995;첸 외.,2009;후지와라 외., 2018)., 그 자체로 plastids 가없는 GCs 는 arc6 에서 발견되지 않았으며,엽록체 분열 장치의 붕괴에도 불구하고 이에 대한 설명은 곧 나오지 않았다(Vitha et al., 2003). 따라서,stomatal 혈통 연구에서 arc6 엽록체의 복제 및 형태를 조사하는 것이 중요 할 것이다. Arabidopsis 돌연변이 연구는 또한이 문제에 대한 또 다른 단서를 제공 할 수 있습니다., 관찰 18%의 떡잎 GCs 에서 구겨진 잎(crl)돌연변이 포함하지 않 plastidic 구조물 세포질에 동의 100%가 리프 mesophyll 세포 포함 중 하나를 네 확대 chloroplasts(아사노 et al.,2004;첸 외.,2009)는 매우 중요합니다. CRL 은 알려지지 않은 기능을 가진 엽록체 외부 봉투 단백질입니다. CRL 단백질 기능을 이해하는 것은 엽록체 분할의 메커니즘(들)에 대한 통찰력을 제공 할 수있다., 분석의 엽록체 확산 및 분할에서 잎 mesophyll 세포 Arabidopsis 호 돌연변이와 다른 유전자 변형선을 추진했 연구로 확산과 분할의 비 mesophyll plastids. 마찬가지로,GCs 에서 얻은 결과는 다른 세포 계통으로 옮길 수 있습니다.
최종 발언
GC 모델은 엽록체 생물학의 발전을위한 많은 전망을 열어 준다. 예를 들어,세포 골격 시스템은 엽록체 형태,이동 및 분할을 조절하는 것으로 알려져 있지만(Sheahan et al.,,2016;Wada,2016;Erickson and Schattat,2018),식물에서의 엽록체 증식 및 분열에서 각 조절 유전자의 역할은 거의 주목을받지 못했다. 다른 한편으로,그것은이 가능해진 손상 GC 엽록체 번호 또는 형태를 통해 다양한 실험적인 전략을,새로운 통찰력을 분자제의 엽록체 morphogenesis in stomatal 혈통 셀활동을 수행할 수 있습니다. 또한,과 함께 정량적 분석의 엽록체 수는 동안 stomatal 개발,수학적 모델링을 제공할 수 있습니다 새로운 길을 위한 이러한 조사., 이 종이 선물은 현재의 지식을 어떻게 GC 엽록체수가 통제되고 하이라이트는 잠재적 유용성의 Arabidopsis 잎 GCs 에 대한 이해를 엽록체 확산 및 분할입니다.
데이터 가용성 진술
본 연구의 모든 데이터 세트는 기사/보충 자료에 포함되어 있습니다.
저자 기고
MF 는 연구를 고안하고 원고를 썼다. Mf 와 같이 실험을 수행했다. AS 와 RI 가 분석을 수행했습니다. 모든 저자는 최종 원고를 읽고 승인했습니다.,
자금 지원
이 작품에 의해 지원되었 교육부,문화,과학 기술의 일본에서 KAKENHI(권한을 부여 nos. 19K05831 을 MF 및 18K06314 을 RI).
이해의 충돌
저자가 선언하는 연구가 수행되었의 부재에서 어떠한 상업 또는 금융 서비스를 제공하는 것으로 해석될 수 있는 잠재적인 이해의 충돌.
인정
저자는 작품에 대한 조언을 간자와 노부유키 박사(소피아 대학)에게 감사드립니다.나는 이것이 내가 할 수있는 유일한 방법이라고 생각한다., 세포 분열에서 세포질 소기관의 분할. Int. 목사 사이톨. 15, 49-86.
Google Scholar
버터 휘젓다,T.(1969). Haploid swedenklee(Trifolium hybridum L.)의 폐쇄 세포 모 세포의 유사 분열에서의 plastid 분포. 플란타 84,230-234. doi:10.1007/BF00388108
PubMed 추상|CrossRef 전체 텍스트|Google Scholar
버터 이탈,T.(1973). 핵 DNA 양에 의한 plastid 분열의 제어. 원형질체 76,167-195. 도이:10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., 담배 메조 필 원형질체 배양 및 식물 재생과 관련된 플라 스티드 수 및 플라 스티드 구조 변화. 플란타 158,329-338. doi:10.1007/BF00397335
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Tirlapur,U.k.,König,K.(2001). 펨 근적외선 레이저 소설로는 도구에 대한 비 침략적인 실시간 높은 해상도의 시간이 경과 영상의 엽록체 부문에서 살고 번들 시스의 세포 Arabidopsis. 플란타 214,1-10. 도이:10.,1007/s004250100597
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Wild,A.,Wolf,G.(1980). 의 효과는 다른 빛의 강도에서 주파수 및 크기의 기공,크기는,세포의 수,크기와는 엽록소는 콘텐츠의 엽록체에서 mesophyll 및 가드 셀 중 ontogeny 의 주의 잎 Sinapis alba. Z.Pflanzenphysiol. Bd. 97, 325–342. doi:10.1016/S0044-328X(80)80006-7
CrossRef 전체 텍스트/Google Scholar
















답글 남기기