| 셰필드대학 | |
| 화학 | VSEPR |
암모니아 또는 네 개의 전자쌍과의 조정 형상의 질소를 기반으로 사면체의 배열 전자 쌍이다. 단지 3 개의 보세 그룹이 있으므로 하나의 고독한 쌍이 있습니다. 그러나 고독한 쌍이’보이지 않기’때문에 암모니아의 모양은 피라미드 형입니다.,r>
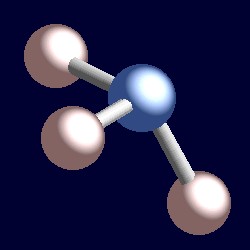
전자의 결합 쌍을 고려하십시오. 두 전자는 두 핵 사이에 위치하며 둘 다 끌립니다. 고독한 쌍은 다릅니다. 그것은 반드시 단지 중 하나에 매력을 핵과 결과는 그것을 채택하는 위치를 효과적으로 가까이하는 하나의 핵보다 결합자의 쌍. 즉,효과적인 단단한 각도에 의해 점령된 고독한 쌍은 더 큰 것보다는 것에 의해 점유 된 유대 쌍입니다., 고독한 쌍은 더 큰 각도 방을 요구하며 결합 쌍보다 원자에 더 가깝게 위치합니다. 이 결과는 암모니아가는 외로운 쌍에 있어서 주요 리스크에 대한 자체를 추진하여 세 가지 수소 원자를 함께 조금 및 H-N-H 채권 각도는 약간 미만(106.6°)보다 이상적인 사용할 수 있는 각도의 109.5°.
















답글 남기기