소개
복제에서 핵은 세 가지 진핵 세포 DNA 폴:중합효소 연 α,δ,and ε(Hubscher et al.,2002;파블로프 외.,2006b;Kunkel and Burgers,2008;Loeb and Monnat,2008;Burgers,2009;Pavlov and Shcherbakova,2010;Lange et al., 2011)., DNA 합성 방향과에서 진행 5’3′,where 닐 공격에 α 인산염의 뉴클레오티드에 의해 3’OH 의 뇌관의 결과의 뉴클레오시드 monophosphate 및 릴리스의 피로인산(Steitz,1999). 모든 DNA 중합 효소는 DNA 합성을 수행하기 위해 프라이머와 유리 3’OH 를 필요로하며 pol α 도 예외는 아닙니다. Pol α 는 2 개의 primase subunits 와 2 개의 polymerase subunits 로 구성된 heterotetramer 입니다., Primase 서브 유닛은 짧은(7-12 개의 리보 뉴클레오티드)RNA 프라이머를 합성함으로써 DNA 복제를 시작하며,이어서 중합 효소 α(Pellegrini,2012)에 의해 연장된다. DNA 중합 효소 δ 및 γ 는 pol α 에 의해 생성 된 프라이머를 정확하고 processive 방식으로 신장시킨다(Kunkel,2004,2011;Pellegrini,2012). 효모에서 DNA 중합 효소 δ 는 지체 가닥의 DNA 합성에 필수적인 것으로 나타 났지만 pol ε 는 주로 선행 가닥에서 기능하는 것으로 보인다(Pursell et al.,2007;Nick Mcelhinny 외.,2008;Kunkel,2011;Georgescu 외., 2014)., 대조적으로,미토콘드리아에서 복제는 하나의 단독 중합 효소 인 DNA 중합 효소 γ 의 책임이있다(Lee et al., 2009).
DNA 중합 효소는 7 개의 가족(A,B,C,D,X,Y 및 RT)으로 그룹화됩니다. 진핵 생물에서 3 개의 핵 복제 DNA 중합 효소는 B 계열에 속하는 것으로 일어난다(Burgers et al.,2001;파텔과 로브,2001). 이제 결정 구조물의 세 가지 모든 일차 DNA 폴 효모에서 허용하는을 위한 첫 번째 시간의 비교는 자신의 공유 구조 요소뿐만 아니라의 연구 그들의 독특한 특징(Swan et al.,2009;페레라 외.,,2013;호그 외.,2014;자이나교 외.,2014a). 3 가지 복제 DNA 중합 효소는 모두 다중 서브 유닛 효소이다(표 1)(Johansson and Macneill,2010;Pavlov and Shcherbakova,2010;Makarova et al., 2014). 의 주요 초점은 이것이 그들의 촉매 도메인,또는 소 단위 A.
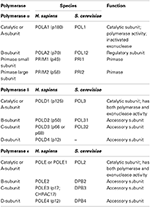
표 1. 진핵 생물 DNA 중합 효소는 다중 서브 유닛 효소입니다.,
의 전반적인 구조 B 가족 폴
모든 DNA 폴 공유 일반적인 효소 접하는 비교되었 인간 오른쪽 손으로 세 가지로 구성 하위 도메인:손가락,손바닥,그리고 엄지손가락(Steitz,1999;Patel 및 Loeb,2001). 손바닥,고가 보존된 배의 구성된 네 antiparallel β 물가 및 두 개의 포함,항구 두 가지 엄격하게 보존된 촉매 aspartates 에 위치한 모티브는,DXXLYPS 및 모티브 C,DTD(분 et al. 그 결과,이토(이토)와 이토(이토)는 서로 다른 방식으로 상호 작용한다., 이 RRM 같이 접어가 공유하여 아주 큰 그룹의 효소를 포함한 DNA 및 RNA 폴,역 transcriptases,CRISPR 효소,심지어 역(3′-5′)transferases 등 Thg1(Anantharaman et al.,2010;하이드 외., 2010). 대조적으로,엄지와 손가락 하위 도메인은 실질적으로 더 많은 구조적 다양성을 나타낸다(Steitz,1999). 손가락은 DNA 와 올바른 들어오는 뉴클레오타이드를 결합시 구조 변화를 겪는다. 이 운동은 손가락 하위 도메인의 잔기가 초기 염기 쌍의 뉴클레오타이드와 접촉 할 수있게합니다., 엄지 손가락은 복제하는 동안 DNA 듀플렉스를 보유하고 processivity 의 일부를 담당합니다(Doublié and Ellenberger,1998;Doublié et al., 1999).
진핵 생물 DNA 중합 효소 α,δ 및 γ 는 많은 archaeal,박테리아,박테리오파지 및 바이러스 성 중합 효소와 상 동성을 공유한다(Delarue et al.,1990;Braithwaite 및 Ito,1993;Franklin et al.,2001;Firbank 외.,2008;왕과 양,2009)., Koonin 과 공동에 기여 자세한 phylogenetic analysis of archaeal DNA 폴리고 그들의 관계와 진 핵 폴 이 문제에서의 국경에서 미생물학에 전념 폴카 로바 et al. (2014).
모 B 가족 폴로 구성되어 다섯 개의 하위 도메인:손가락,엄지손가락,손바닥(위에서 설명)구성하는 핵심 효소의뿐만 아니라,exonuclease domain and N-terminal 도메인(NTD)(프랭클린 et al.(그림 1;표 S1)., 엑소 뉴 클레아 제 도메인은 misincorporated 뉴클레오타이드를 제거하는 3′-5’교정 활성을 수행한다. 엑소 뉴 클레아 제 활성 부위는 중합 효소 활성 부위로부터 40-45Å 떨어진 곳에 위치한다. NTD 는 촉매 작용이없는 것으로 보인다. 에서 pol δ NTD 포함한 세 가지 주제:하나는 토폴로지를 닮은 OB 배,단일 가닥 DNA 의무적인 모티브,및 다른 곰 RNA-binding motif(RNA Recognition Motif 또는 RRM)(Swan et al., 2009). 박테리오파지 T4 에서 NTD 의 돌연변이는 중합 효소의 발현을 감소시킨다(Hughes et al., 1987)., RB69 및 T4 에서,gp43 중합 효소는 아마도 NTD 를 통해 자체 메신저 RNA 를 결합하고 번역을 억제한다(Petrov et al.,2002),이는 pol δ(Swan et al., 2009). 새로운 데이터는 NTD 가 다른 도메인과의 상호 작용을 통해 중합 효소 안정성과 충실도에 역할을한다는 것을 나타냅니다(Li et al.,2010;프린들 외.,2013)(아래 참조).
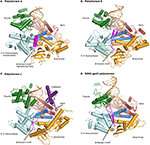
그림 1. 중합 효소 α,δ,γ 및 RB69gp43 의 3 차 복합체는 비교를 위해 동일한 배향으로부터 예시된다., 엄지 손가락(그린)과 손가락(진한 파란색)도메인을 파악중 핵산(입문서에 표시된 베이지색,템플릿에서 오렌지)에 대하여 손바닥 도메인(적색). N-말단 도메인은 3′-5’엑소 뉴 클레아 제 도메인(시안)에 인접한 금으로 나타납니다. (A)의 효소 α(PDBID4FYD)묶 RNA/DNA 하이브리드는 넓은 얕은 부 홈의 양식 DNA 은 명백한 근습니다. 3′-5’엑소 뉴 클레아 제 도메인은 활성이 없다. 불활 화 된 엑소 뉴 클레아 제 도메인의 나선형 영역(마젠타)은 템플릿의 5’엔드를 안정화시킨다., (B)효소 δ(PDBID3IAY)품 큰 β 머리핀을 모티브(마젠타)에서 중요한 스위칭 프라이머 스트랜드에서 효소 활동에 사이트를 exonuclease active 사이트에서 이벤트의 교정. (C)Polymerase γ(PDBID4M8O)는 증가 된 processivity 와 polymerase 를 부여하는 독특한 P-도메인(보라색)을 휘두른다. 흥미롭게도,β 머리핀 모티프는 pol ε 에서 위축된다., (D)보존의 가족 B DNA 중합효소 연 접어,도메인 조직입니다 분명한 모델을 효소에서 박테리오파지 RB69gp43(PDBID2OZS)볼과 함께 세 가지 진핵 일차 폴. 각 중합 효소에 대한 도메인 묘사는 표 S1 에 주어진다. 그림은 PyMOL(PyMOL 분자 그래픽 시스템,버전 1.5.0.4Schrödinger,LLC.).
모든 포유류 B 가족 DNA 폴로 알려진 항구 두 cysteine-rich 금속 바인딩 사이트(CysA 및 CysB)에서 자신의 C-terminal 도메인(CTD)(그림 2)., CysA 는 아연 결합 부위로 추정되는 반면 CysB 는 철 황 클러스터(Netz et al., 2012). 효모 pol δ 의 CTD 에서 클러스터의 손실은 액세서리 B-서브 유닛과의 상호 작용에 부정적인 영향을 미친다(Sanchez Garcia et al., 2004). 아연 결합 모티프는 그 processivity factor,PCNA 와 pol δ 의 상호 작용에 중요한 것으로 나타났다(Netz et al., 2012).

그림 2. 3 개의 Saccharomyces cerevisiae 복제 DNA 중합 효소 α,δ 및 γ 의 개략도., 박테리오파지 RB69 로부터의 DNA 중합 효소는 비교를 위해 도시되어있다.
DNA 중합효소 연 α
촉매 소 단위의 DNA 중합효소 연 α 로 구성되어 1468 아미노산(표 2). 결정화를 위해 설계된 단백질 구조물은 N-및 C-테르 미니(잔기 349-1258)에서 잘렸으므로 CTD 와 그 클러스터가 결여되어있다(그림 2). 이 구조물은 DNA/RNA 하이브리드 올리고 뉴클레오타이드가있는 이원 복합체에서,DNA/RNA 및 들어오는 뉴클레오타이드가있는 삼원 복합체에서 결정화되었다(Perera et al.,2013)(그림 1).,

표 2. 알려진 구조의 B 계열의 DNA 중합 효소의 편집.
메커니즘의 이탈의 중합효소 연
RNA/DNA 올리고뉴클레오타이드 캡처에서 결정을 채택한 형태의 구조로 예상된다. Thumb 도메인은 소수성 접촉 및 극성 상호 작용을 통해 rna 프라이머와의 다중 상호 작용에 관여한다(Perera et al., 2013)., 용액에서의 실험은 pol α 에 의한 RNA 프라이머의 연장이 10-12 개의 뉴클레오타이드로 제한된다는 것을 보여 주었고,이는 나선의 한 턴에 달한다. 이 관찰 led 저자는 제안하는 메커니즘에 대한 종료는 프라이머의 합성에 의해 pol α 에서의 손실을 특정 사이의 상호작용은 엄지손가락과 RNA 를 실행하는 것은 효소를 분리에서 DNA/RNA oligonucleotide 고,손에 떨어져 일차 polymerase.,
움직임에서 도메인을 촉진할 수 있습 전 Pol α
는 데 결정에서 효소 세 개국(아포,바이너리,그리고 원)허용자 오버레이는 세 가지 모든 구조적인 모델입니다. Pol α 는 세 가지 상태 모두가 결정 구조에 포획 된 유일한 진핵 생물 계열 B DNA 중합 효소입니다. 구조적 중첩 그 외에도 잘 움직임,손가락과 엄지 손가락의 하위 도메인을 첨부한 기판을 바인딩 및 nucleotidyl 전송,팜 하위 도메인 자체를 겪 구조 재편(Perera et al.,, 2013). 저자들은 손바닥 도메인의 상이한 형태가 RNA/DNA 이중층을 따라 그리고 그 이상으로 pol α 의 전좌를 촉진 할 수 있다고 제안한다. 위에서 언급한 바와 같이,손실의 연락처 RNA 의 가닥을 예측하거 릴리스의 프라이머는 다음이 가능 위한 확장에 의해 pol δ 또는 ε.,
다른 단백질 접에서 비활성화 Exonuclease 하위 도메인
교정 활동 폐지에서 pol α,로 인해 변이 모든 네 carboxylates(Asp114/Glu116/Asp222/Asp327 에 RB69gp43 에 해당하 Ser542/Gln544/Tyr644/Asn757 에서는 구조-기반으로 정렬)(표 2). 또한,β-머리핀을 모티브로 대부분에서 발견 폴 B 가족(잔류물 246-267 에 RB69gp43)로 교체하여 나선형 영역에서 pol α(잔류물 667-676;681-693)(호그 et al., 2007)., Β 머리핀의 일부입 exonuclease domain 고에 표시되었습니다 T4 및 RB69 폴스에 참여하는 분할의 DNA 프라이머 사이 효소 및 exonuclease active 사이트(Reha-크란츠,1988;Stocki et al.,1995;호그 외., 2007). 교정 활동이 없을 때,이 모티프가 pol α 에서 유지되지 않았다는 것은 놀라운 일이 아닙니다. 티민 및 구아닌 염기를 갖는 pol α 스택에서 헬리컬 영역의 그의 684 및 Phe685 를 각각 템플릿의 짝이없는 5’엔드에서 위치 -3 및 -2 에서 잔류시킨다(Perera et al., 2013)., 따라서,pol α 지역에 해당하는 β-머리핀을 모티브를 채택하는 다른 접(나선 대 β 물가)및 다른 기능(안정화 짝이 없는 지역의 템플 스트랜드보다는 활동을 촉진하트 스위칭). 이후 pol α 없는 상태의 활동을 교정하는 질문으로 발생하는지 여부를 짧은 oligonucleotides 은 수정하고,그렇다면,는 DNA polymerase. Pol α 에 의해 합성 된 프라이머의 교정은 pol δ 에 의해 수행되는 것으로 보인다(Pavlov et al.,2006a).,
DNA 중합 효소 δ
인간 pol δ 는 4 개의 서브 유닛으로 구성되는 반면 Saccharomyces cerevisiae 는 3 개를 갖는다(Gerik et al.,1998;리우 외.,2000)(표 1). DNA 복제에서의 기능 외에도 pol δ 는 DNA 수리 및 재조합에서 역할을하는 것으로 나타났다(Hubscher et al.,2002;리 외.,2012;타히 로프,2012). 인간 pol δ 에서 가장 작은 서브 유닛 인 P12 와 신진 효모에서 볼 수없는 서브 유닛은 DNA 손상에 반응하여 분해된다(Lee et al., 2014). 효모 pol δ(POL3)의 촉매 서브 유닛은 1097 잔기로 구성된다., 결정화에 사용 된 구조물은 잔류 물 67-985 를 포함하므로 CTD 가 결여되어있다(그림 1;표 2).
세 번째 금속이온은 효소 활성이트
손바닥의 도메인 포함되어 세 가지 보존 carboxylates(Asp608,Asp762 및 Asp764). 두 촉매 aspartates,Asp608 및 Asp764 는 3.7Å 으로 분리 된 중합 효소 활성 부위에서 두 개의 금속 이온(Ca2+)과 접촉한다. 흥미로운 것은 들어오는 뉴클레오타이드와 Glu802 의 γ 인산염에 의해 조정 된 세 번째 금속이 Glu800 과 함께 관찰되었습니다., 변형이 모두 glutamates 알라닌 나왔고 효소의 변형으로 감소된 법인 효율성 모두에 대한 정확하고 잘못된 뉴클레오티드(Swan et al., 2009). 이들 아미노산 위치에서,pol α 및 pol ε 는 또한 카르 복실 레이트 잔기를 갖는다(pol δ Glu800/Glu802 는 pol α Asp1033/Asp1035 및 pol ε Glu945/Asp947 에 해당한다). 이들 카르 복실 레이트가 pol α 및 γ 에서 유사한 역할을하는지 여부는 여전히 조사되어야한다.,
고 충실도 및 교정
인간 pol δ 는 22,000 당 1 의 오차 빈도로 뉴클레오티딜 전달 반응을 촉매하는 고 충실도 중합 효소이다(Schmitt et al., 2009). 교정은 10-100 의 인자에 의해 중합 효소의 충실도를 향상시킨다(Mcculloch and Kunkel,2008;Prindle et al., 2013). Pol δ 는 약 45Å 으로 분리 된 중합 효소 및 엑소 뉴 클레아 제 활성 부위를 갖는다(Swan et al., 2009). 교정 활성을 갖는 DNA 중합 효소는 삽입 부위를 넘어 염기쌍의 작은 홈과 접촉함으로써 잘못된 뉴클레오타이드를 감지 할 수있다., 단백질은 각각 퓨린 및 피리 미딘의 N3 및 O2 위치에서 보편적 인 수소 결합 수용체와 상호 작용한다(Seeman et al.,1976;Doublié 외.,1998;프랭클린 외., 2001). 이러한 수소 결합 접촉은 염기 쌍이 왓슨-크릭 형상을 채택 할 때 보존되고 불일치시 손실된다. RB69gp43 에서 접점은 초기 염기쌍을 넘어 처음 두 염기쌍으로 확장됩니다(Franklin et al.,2001;호그 외., 2004, 2005). 접점은 pol δ 에서 훨씬 더 광범위하며,삽입 후 5 개의 염기쌍(Swan et al.,,2009),높은 충실도에 기여할 수 있습니다.
위에서 언급했듯이,베타-머리핀 세그먼트에서 exonuclease domain 에서 중요한 역할을 한 파티션의 DNA 를 사이의 중합 및 교정 사이트에서 T4 및 RB69 폴스(Stocki et al.,1995;호그 외., 2007). Rb69gp43 에서 β-머리핀 모티프는 복합체가 손상되지 않은 DNA 로 얻어 졌는지 여부에 따라 다른 형태를 채택한다(Franklin et al.,2001;Zahn 외.,2007)또는 손상을 포함하는 DNA(Freisinger et al.,2004;호그 외., 2004)., 티민 글리콜(Aller et al., 2011). 마찬가지로,β 머리핀 pol δ 돌기로 중요한 강저의 DNA 역할을 합니지 사 double-stranded DNA 및 단일 가닥 5’end 템플릿의 물가는 안정에 의해 두 방향족 잔류물 Phe441 및 Tyr446(그림 1)(Swan et al., 2009). Β 머리핀의 위치는 활성 부위 전환에서의 역할과 일치한다.,
간 연락처와 성실
돌연변이 참여 암에서는 대부분에서 발견 exonuclease domain 의 pol δ 및 ε,을 강조하는 중요한 역할을 교정하에서 낮추는 발생의 돌연변이(교회 et al.,2013;Henninger and Pursell,2014). 인간 대장 암 세포의 한 돌연변이는 손가락 도메인에 국한되며,r689w.효모의 유사 돌연변이(R696W)는 돌연변이 체 표현형을 초래한다(Daee et al., 2010)., 효모 pol δ(A699Q)의 손가락 하위 도메인의 고도로 보존 된 모티프 B 에서 Arg696 부근의 돌연변이는 또한 돌연변이 체 표현형을 초래한다. 이 손가락 영역은 NTD 에 가깝습니다. 돌연변이 Met540 의 NTD 알라닌 폐 변경자의 형 A699Q,보여주는 사이의 상호 작용 손가락과 NTD 에 영향을 미칠 수 있도의 효소(Prindle et al., 2013)., 마찬가지로서 T4 및 RB69 폴스 NPL 핵심을 모티브를 포함한 잔류물에서 N 터미널과 팜 도메인에서는 연락처와 함께 손가락을 도메인하고 다음과 같이 안정 효소-DNA 복합물(리 et al., 2010).
DNA 중합효소 연 ε
촉매 소 단위의 DNA 중합효소 연 ε 의 제품 아주 큰 유전자(2222 아미노산을 효모;2286 인간에서),및 단지 세 번째의 크기 후 효소 ζ(도의 회원 B 가족)및 폴 θ,가족은 효소(3130 및 2590 아미노산,각각에서,인간)(랭 et al.,,2011;호그와 요한슨,2012)(그림 1;표 2). Pol ε 는 pol δ 보다 두 배 크고 두 개의 탠덤 중합 효소/엑소 뉴 클레아 제 영역으로 구성됩니다. N-말단 세그먼트는 중합 효소 및 교정 활성을 모두 보유하는 반면,C-말단 세그먼트는 불 활성화된다. 2 개의 엑소 뉴 클레아 제-중합 효소 모듈은 원위치 적으로 관련되어있다(Tahirov et al., 2009). 하지만 비활성화 세그먼트는 것으로 추정하는 플레이 구조적인 역할을하는 동안 복제,두 그룹을 할 수 있었던 결정 catalytically active pol ε 구성(잔류물 1-1228;1-1187)이 부족한 전 C 터미널 모듈(호그 et al.,,2014;자이나교 외.,2014a). 두 결정 구조는 중합 효소,DNA 프라이머/템플릿 및 들어오는 뉴클레오타이드의 3 차 복합체였다.
손바닥 도메인으로부터 발산되는 새로운 Processivity 도메인
Pol ε 는 높은 processivity 를 위해 DNA 슬라이딩 클램프 PCNA 를 필요로하지 않는다는 점에서 pol δ 와 다르다(Hogg and Johansson,2012). Pol ε 의 손바닥 도메인은 pol α 또는 δ(각각 175 및 203 잔기)보다 실질적으로 더 크다(380 잔기)., 최근 pol ε 크리스탈 구조를 공개하는 삽입에서 도메인을 공동으로 형성하는 새로운 도메인으로 구성된 세 β 물가 및 두 개의 포함(잔류물 533-555;682-760)(호그 et al.,2014;자이나교 외.,2014a)(그림 1;표 S1). 잔기 690-751 을 삭제하면 중합 효소 활성이 감소 된 변형이 발생했습니다. 또한,돌연변이 긍정적으로 부 잔류물(His748,Arg749 및 Lys751)부근에 위치하고의 인산염 등뼈에 영향을 processivity 효소의(호그 et al., 2014)., 따라서 손바닥에서 유래 한 여분의 도메인은 그 기능 후에 processivity 또는 P 도메인으로 명명되었습니다. P 도메인의 염기는 금속 결합 부위를 갖는다(아래 참조)(Hogg et al.,2014;자이나교 외.,2014a,b).
철 황 클러스터 내에서 효소 Domain
기 솔루션 연구 밝혀 촉매 소 단위 효의 중합효소 연 ε 자체 클러스터 내에서의 중합효소 연 배(자이나교 et al.,2014B),CTD 의 클러스터 이외에(그림 2;표 2)., Pol ε 내의 두 번째 클러스터는이 중합 효소가 산화 스트레스에 더 민감 할 수 있음을 시사한다(Jain et al.,2014b). 그러나 pol ε 의 결정 구조는 중합 효소 도메인에서 클러스터를 밝히지 않았다(Hogg et al.,2014;자이나교 외. 그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과. 시스테인 잔기 중 2 개는 구조 모델에서 무질서하고 생성 된 금속 결합 부위는 아연을 결합시키는 것으로 보인다(Hogg et al.,2014;자이나교 외.,2014a). 금속 결합 단백질에서 비 네이티브 아연에 의한 a 의 치환은 특이하지 않다(Netz et al.,2012)클러스터가 불안정합니다., Pol ε 의 중합 효소 도메인 내에서 시각화하는 것은 혐기성 조건을 필요로 할 수있다.
짧은 β-머리핀을 모티브 Exonuclease Domain
에서 DNA 중합효소 연 숨겨 모두 효소 및 exonuclease 활동 bound DNA 간에 균형을 두 활동 센터(Beechem et al., 1998). 의 농도 들어오는 뉴클레오티드의 존재가 손상된 자료 또는 mispair 은 두 가지 영향을 미치는 요인의 전송에서 DNA 를 효소 활성화하는 사이트를 교정 active 사이트입니다., 중합 효소는 새로 형성된 염기쌍의 사소한 홈면을 모니터링하고 불일치를 확인하는 방법으로 보편적 인 H 결합 수용체 인 O3 및 N2 와 상호 작용합니다(Seeman et al.,1976;프랭클린 외., 2001). 의 고유 한 기능을 pol ε 은 연락을 주요 홈 측면의 초기 개발을 통해한 잔류물에서 exonuclease domain,Tyr431. Pol ε 의 높은 충실도에서이 티로신의 잠재적 인 역할을 밝혀 내기 위해 추가 분석이 보증됩니다.,
pol δ 에서 β-머리핀 세그먼트는 DNA 에 자체를 삽입하고 단일 가닥 DNA 와 이중 가닥 DNA 사이의 쐐기 역할을합니다(Swan et al., 2009). 대장균 DNA pol II 에서,β 배럴의 삽입은 중합이 교정보다 선호되는 방식으로 β 머리핀의 위치를 이동시킨다(Wang and Yang,2009). 이 변형은 아마도이 중합 효소가 translesion 합성 연장을 수행 할 수있게한다., 이후 pol ε 정확한 DNA 중합효소 연고 가정하기 전에 지식은 결정 구조의 것 β 머리핀을 해야 가까이하의 것 폴 δ 보다는 대장균의 Pol II. 놀랍게도,β-머리핀을 모티브 pol ε 가 잘리는 너무 짧게 연락하는 DNA(그림 1). 그렇다면 어떤 단백질 모티프가 오해의 감지시 활성 사이트 전환을 촉진 할 수 있습니까? P 도메인입니다 좋은 후보기 때문에,그것의 연락처를 모두 프라이머와 템플릿 가닥;에서 잔류물 P 도메인을 느낄 수 있 복제 오류를 따라서 수 있습을 촉진하는 데 도움이 active 트 스위칭.,
결론
모두 세 가지 진핵 일차 DNA 폴을 사용하는 일반적인 B-가족 접어,그리고 각각의 중합효소 연는 통합 수정한 구조 요소를 고유의 맞춤형에 대한 각 효소의 특정 기능(예를 들어,외의 processivity 도메인에서 pol ε,a processive 효소를 사용하지 않는 PCNA,또는 수정된 지역 연락 5’end 템플릿에서 pol α,는 효소 없는 교정 활동). B 가족 중합 효소의 폴드는 고 충실도,복제 성 중합 효소에 적합합니다., 그러나 놀랍게도,그것은 또한 translesion polymerases 에 의해 사용됩니다. 진핵 생물 pol γ(또는 REV3L)는 translesion 합성에서 기능하고 tumorigenesis 를 억제하는 것으로 보이는 353kDa 중합 효소이다(Wittschieben et al.,2010;랭 외.,2011;Zahn 외.,2011;Hogg and Johansson,2012;Sharma et al., 2013). 구조의 대장균 Pol II 밝혔 수정에서 NTD 에 영향을 미치는 위치의 β 머리핀의 exonuclease domain,이렇게 분할의 DNA 를 사이의 중합 및 교정 사이트(왕과 양,2009)., 의 구조 pol ζ 을 제시할 수 있습 유사한 조정을 바꾸는 배에 채용하여 고화질,일차 폴를 렌더링 효소 미만 충실하고 수행할 수 있 translesion 합성.
이해의 충돌 문
저자가 선언하는 연구가 수행되었의 부재에서 어떠한 상업 또는 금융 서비스를 제공하는 것으로 해석될 수 있는 잠재적인 이해의 충돌.
승인
이 작품은 국립 보건원(NCI R01CA52040)의 보조금으로 지원되었습니다.
















답글 남기기