US Pharm. 2010;35(5):36-41.糖尿病(DM)と認知症との関係は否定できず、DMがアルツハイマー病(AD)を含む認知機能低下および認知症のリスクを増加させると結論付けられている多く1-5DMは認知症のリスクを高めるだけでなく、実際には認知症の発症率を二から三倍に増加させます。,3この障害のメカニズムは完全には理解されていませんが、高血糖、インスリン抵抗性、酸化ストレス、高度糖化最終産物、および炎症性サイトカインが総称して認知機能障害につながると仮定されています。5実際は、糖尿病は多くの準の複雑化のために1976年に”特別な一種の加速された老化”として記述されていました。,5DMと認知症の間の明らかな重複は、ADが単に神経学的障害ではなく、むしろ神経内分泌障害であるという提案につながり、Steenらはこのハイブリッド病を記述するために3型糖尿病という用語を造語している。,6
インスリン抵抗性/耐糖能障害の概要
病態生理:耐糖能障害—経口耐糖能試験後140mg/dLから199mg/dLの血漿グルコースとして定義される—および100mg/dLから125mg/dLの空腹時グルコースとして定義される—は、前糖尿病(2型DMの前駆体)の診断であり、ヘモグロビンA1Cは5.7%から6.4%である。7前糖尿病の病態生理はT2DMのそれと同じであり、これは126mg/dL以上の空腹時血糖またはA1Cの6の後に診断される。,5%またはより大きい(確認のために繰り返されるテスト7両方の条件では、インスリン抵抗性はインスリンがブドウ糖の通風管(即ち筋肉、レバーおよび脂肪)に要求され、膵臓がこの抵抗を克服するためにます8この段階では、患者は頻繁にhyperinsulinemicです;但し、そのうちに、膵臓はティッシュの要求に応じることができないし膵臓のインシュリン作り出すベータセルはゆっくり失敗し、ますますより少ないインスリンを作り出します。,8十分なインスリンなしで、血ブドウ糖の集中は上がり、前糖尿病および、前糖尿病の患者の70%までで、T2DMをもたらします。9高血糖の合併症は多くあり、大血管合併症心筋梗塞、脳血管事故、末梢血管疾患を含むおよび微小血管合併症腎症、神経障害、網膜症を含むリスクの高7
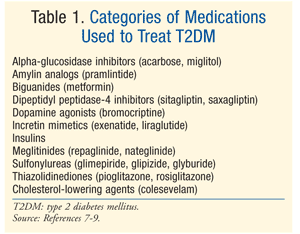
治療:DMを治療するための多くの治療法が存在する。, 前糖尿病およびT2DM両方のための最初の処置は食事療法、練習および減量を含む生活様式の修正です。7アメリカの糖尿病連合(ADA)はまた糖尿病を開発するための危険度が高いにあるprediabetesを持つ患者のmetforminの考察を推薦します。7MetforminはT2DMのための最初のpharmacologic療法として推薦されます。7多くの場合、A1C<7%を含むADA血糖目標を達成するために追加の薬理学的療法が必要である。,7T2DMのための投薬には多数のクラスがあり(表1)、血糖を正常化するための薬剤の選択は、患者および投薬固有の要因のホストに依存する。 T2dmの多くの患者が結局外因性のインシュリンがベータ細胞機能が漸進的に低下すると同時にeuglycemiaを達成し、維持するように要求することに注意する
ADの概要
病態生理:ADは高齢者の認知症の最も一般的な形態であり、すべての症例の60%から80%を占めています。,10ADの二つの病理組織学的特徴は、神経突起プラークと神経原線維のもつれです。11個のプラークは不溶性のβ-アミロイドタンパク質からなる。 細胞内であるもつれは、リン酸化されたタウタンパク質から構成されている。 タウタンパク質は微小管の集合に重要であり,このタンパク質が異常にリン酸化されると神経機能が中断される。 神経原線維のもつれは、最も一般的にコリン作動性ニューロンに影響を与えます。12さらに、主興奮性神経伝達物質であるグルタミン酸の破壊は、ADの病理に寄与する。, ADでは、プラーク形成、タウタンパク質の過リン酸化、および細胞死につながる興奮毒性として知られているプロセスをシグナル伝達グルタミン酸の過活性化があります。12要約すると、興奮毒性および神経突起プラークおよび神経原線維のもつれの形成は、ADに関連する学習および記憶障害をもたらす神経伝達物質経路
処置:ADのための利用できるFDA公認の薬理学療法は表2に要約されます。,11,12ADの病理学を扱うか、または変える療法に関して学ばれるべき多くがまだある間、現在利用できる療法は四つがあるacetylcholinesteraseの抑制剤およびN-methyl-d-aspartateの受容器の反対者のメマンチンの使用を含みます。

インスリンと脳
末梢組織へのグルコース輸送に必要であるが、インスリンは脳へのグルコース輸送または脳グルコース代謝に必要ではないようである。, 脳へのグルコース輸送はインスリンに依存しないが、インスリン自体はインスリン受容体媒介輸送プロセスによって血液脳関門(BBB)を越えて運ばれる。13この輸送機構は飽和可能であり、前糖尿病およびT2DMに見られるような末梢の過剰なインスリン濃度(高インスリン血症)が長期間続くと、この受容,
インスリンに加えて、インスリン様成長因子1型(IGF-1)は脳内に存在し、中枢神経系(CNS)の正常な成長および機能に必要である。14インスリンおよびIGF-1受容体は、ニューロンおよびアストロサイト(脳のニューロンをサポートするのに役立つCNSの星型細胞)に脳全体に位置しています。 学習と記憶のために重要である脳の二つの領域、海馬と視床下部は、インスリン受容体の高濃度を含んでいます。5ラットでは、脳室内インスリン投与は記憶を増強することが示されている。,15さらに、ヒトにおける鼻腔内インスリン投与は、記憶性能を増加させることが見出されている。16先に述べたように、インシュリンは大脳のブドウ糖の新陳代謝に要求されません;但し、インシュリンがブドウ糖を含む代謝過程を誘発する頭脳 ラット研究では、インスリンは、視床下部および座座coeruleus、学習および記憶のために重要である二つの領域におけるグルコース利用に影響を与えることが示されている。,17学習はまた頭脳のインシュリンの存在そして活動がに貢献し、学習および記憶の必要な役割を担うという仮定をもたらすCNSのインシュリンの受容器の高められた表現を促進するために示されていました。 インスリンはまた正常な認知および頭脳の健康のために重大であるCNSの神経伝達物質、特にアセチルコリンおよびノルエピネフリンの調節に貢献,18
インスリン抵抗性および認知症
概要:AD患者の脳におけるインスリンシグナル伝達に多くの欠陥があり、グルコース利用およびエネルギー代謝6,19T2DMは末梢インスリン抵抗性と関連しているので、ADは脳インスリン抵抗性と関連している。20初期のADでは、インスリン抵抗性の兆候である脳内の不十分なインスリン取り込みとシグナル伝達があるようです。5,19,21,22増加したインスリン受容体は、おそらくインスリン抵抗性の補償として、AD患者の脳に見られている。,21
全体的に、インスリンシグナル伝達におけるこの障害は、ADにおける多くの下流の効果を有する。 一つの理論は、中枢神経系におけるインスリンの低濃度は、アセチルコリンレベルと脳血流の減少を引き起こすということです。13さらに、インスリンの集中の変化はベータアミロイドおよびtau蛋白質の形成を促進するかもしれません。2脳では、インスリン分解酵素(IDE)は、β-アミロイドタンパク質の分解およびクリアランスに関与している。インスリンの21のハイレベルはIDEを禁じ、ベータアミロイドの整理の減少をもたらし、続いてベータアミロイドの頭脳の沈殿を高めるかもしれません。,5,19,21
最近、脂質のファミリーであるセラミドは、インスリン抵抗性および認知症における潜在的な役割のために注目を集めている。23,24セラミドは、肥満、T2DM、およびADで一般的である炎症の存在下で生成される。24セラミドはBBBを容易に通過するため、暴露によりエネルギー代謝障害やインスリン遺伝子発現の変化が引き起こされ、インスリン抵抗性に寄与する。23,24これは現在、セラミド合成を阻害すると肥満媒介インスリン抵抗性が防止されることを実証している研究者との関心の活発な領域である。,24
鼻腔内インスリン:前述したように、鼻腔内インスリン投与は、ヒトにおける記憶性能を改善する。16鼻腔内インスリンのいくつかの研究が実施されている。 ヒト被験者に20単位の鼻腔内インスリンを毎日二回投与すると、Regerらは、プラセボと比較して、インスリンで治療されたグループがより多くの口頭情報を保持し、改善された注意および機能状態を示したことを見出した。,25これらの研究者はまた、空腹時の血漿グルコースおよびインスリンは、鼻腔内インスリン使用で変化しなかったことに留意し、鼻腔内投与が末梢作用なしにCNSへの直接インスリンアクセスを提供することを示した。25,26
PPAR-Γアゴニスト:末梢インスリン抵抗性の治療のために広く研究され、チアゾリジンジオンロシグリタゾンおよびピオグリタゾンは、ADの治療におけるそれらの役割のために調査されている。 チアゾリジンジオンはペルオキシソーム増殖剤活性化受容体(PPAR)-γアゴニストである。, PPARガンマはブドウ糖および脂質代謝にかかわり、発火、ADへの知られていた貢献者を調整します。22,27Thiazolidinedionesはインシュリン抵抗性を減らすために働くインシュリンの感作です;それらはまた発火を減らすようです。21,26いくつかのプラセボ対照試験では、ロシグリタゾンで治療された患者は、改善された記憶および認知機能を示した。21,22,28pioglitazoneの小さい調査だけが行なわれたが、この薬物はまた記憶および認知の改善と関連付けられました。,22ピオグリタゾンおよびロシグリタゾンはBBB透過性が悪いが、これらの薬剤のそれぞれは経口投与後の脳に記録されている。22これらの薬剤はADの予防または治療において役割を果たすかもしれないが、現在、AD患者に対してFDA承認されておらず、その潜在的な利益およびリスクは個々に徹底的に考慮されなければならない。
有酸素運動:おそらく最も効果的で、最も見落とされている、インスリン抵抗性を低下させる方法は身体活動です。, 肥満はインスリン抵抗性、糖尿病、痴呆およびADの高められた危険と関連付けられました。29,30運動の改善にインスリン感受性および低周辺インスリンです。体重とは無関係に26,31の身体活動は、ADのリスクが低く、唯一の実績のある神経保護療法となっています。29-31この神経保護の可能なメカニズムは、運動がβ-アミロイドタンパク質のクリアランスを促進し、脳由来の神経栄養因子、認知およびADで減少するニューロンの生存に不可欠な成長因子を増加させることである。,32
薬剤師の役割
薬剤師は、新しい治療法について患者を教育する上で不可欠な役割を果たしています。 3型糖尿病はそのような状態の一つです。 糖尿病と認知障害との間のこの潜在的な新しいつながりについて学ぶべきことがたくさん残っていますが、一般の人々は医療提供者の意見を求め さらに、糖尿病患者の多くは、より多くの学習に興味を持ち、薬剤師に情報を求めるようになります。, 従って、薬剤師は彼らの患者とこの条件の現在の理解を論議し、また彼らの個々のcomorbiditiesを与えられる危険を減らすかもしれない作戦についてのそれらに
結論
3型糖尿病をよりよく特徴付け、予防および治療戦略を開発するための集中的な研究が進行中である。 今日まで、DM患者における認知低下またはADの予防において実証済みの有効性を有する特定の治療法は存在しない。, したがって、DM患者における認知障害の管理は、血糖コントロールおよび心血管危険因子に特に注意を払って、DMなしの患者の管理と同じである。 これはDM関連の複雑化を防ぐために既に必要な同じアプローチです。 いくつかの患者群は認知障害のリスクが高いように見えるが、DM患者の大部分は明確に定義された臨床的関連を持っていない。, 具体的な治療選択肢はありませんが、現在の論理的なアプローチは、血糖コントロールを達成し、高脂血症や高血圧などの心血管リスク要因を慎重に管理することです。
1. スチュワートR、Liolitsa D.2型糖尿病、認知障害および認知症。 ディアベット-メッド
2. Xu WL,von Strauss E,Qiu CX,et al. 制御されていない糖尿病は、アルツハイマー病のリスクを増加させる:人口ベースのコホート研究。 ディアベトロジア 2009;52:1031-1039.
3. アルバニタキスZ、ウィルソンRS、ベネットDA。 高齢者における糖尿病、認知症、および認知機能。, J Nutrヘルスエイジング。 2006;10:287-291.
4. Jacobson AM,Musen G,Ryan CM,et al. 認知機能に対する糖尿病およびその治療の長期的な影響。 N Engl J Med. 2007;356:1842–1852.
5. ホイットマー-ラー 認知障害および認知症の2型糖尿病およびリスク。 Curr Neurol Neurosci Rep.2007;7:373-380.
6. Steen E,Terry BM,Revera EJ,et al. 障害者インスリンおよびインスリン様成長因子の発現を制御するシグナル伝達系アルツハイマー病ではこの3型糖尿病? ジェイアール-ディス 2005;7:63-80.
7. アメリカ糖尿病協会。 糖尿病における医療の基準—2010。, 糖尿病のケア。
8. トリプリットCl,Reasner CA,Isley WL. 真性糖尿病。 In:Dipiro JT,Talbert RL,Yeegc,et al,eds. 薬物療法の原則&練習。 第7回エディション ニューヨーク,NY:McGraw Hill Medical;2008:1205-1241.
9. Nathan DM,Buse JB,Davidson MD,et al. タイプ2の糖尿病のhyperglycemiaの医学管理:療法の開始そして調節のための一致のアルゴリズム:糖尿病の調査のためのアメリカの糖尿病連合そしてヨーロッパ連合の一致の声明。 糖尿病のケア。
10. Hebert LE,Scherr PA,Bienias JL,et al., アルツハイマー病の人口普及推計値を用い、2000年人口センサス アーチ-ニューロール 2003;60:1119-1122.
11. カミングス-J-アルツハイマー病 N Engl J Med. 2004;351:56-67.
12. スラッタムPW、スワードロー RH、ヒルAM。 アルツハイマー病 In:Dipiro JT,Talbert RL,Yeegc,et al,eds. 薬物療法の原則&練習。 第7回エディション ニューヨーク,NY:McGraw Hill Medical;2008:1051-1065.
13. クラフトS、ワトソンGS。 インスリンおよび神経変性疾患:共有および特定のメカニズム。 ランセット-ニューロール 2004;3:169-178.
14. デ-ラ-モンテSM、ワンズJR., 中枢神経系におけるインスリンおよびインスリン様成長因子発現、シグナル伝達、および機能不全のレビュー:アルツハイマー病との関連性。 ジェイアール-ディス 2005;7:45-61.
15. パークCR、シーリー RJ、クラフトS、ウッズSC。 脳室内インスリンは受動回避タスクにおける記憶を増強する。 フィジオール 2000;68:509-514.
16. Fehm HL,Perras B,Smolnik R,et al. ヒトにおける神経ペプチド性経路の操作:神経薬理学への新しいアプローチ? ユーロ-ジャーマコール 2000;405:43-54.
17. 趙WQ、アルコンDL. 学習と記憶におけるインスリンとインスリン受容体の役割。, モルセルエンドクロニノール。 2001;177:125-134.
18. Kopf S、Baratti C.マウスにおける慣れ応答の保持に対するインスリンの訓練後投与の影響:中枢コリン作動性メカニズムの関与。 ニューロバイオールは、Memを学びます。
19. Revill P,Moral MA,Prous JR.インスリンシグナル伝達障害およびアルツハイマー病の病因。 今日のドラッグ(Barc)。 2006;42:785-790.
20. Moroz N,Tong M,Longato L,et al. 実験的肥満および2型糖尿病における限られたアルツハイマー型神経変性。 ジェイアール-ディス 2008;15:29-44.
21. ハーン-ムーン, 治療の洞察:2型糖尿病および後期発症アルツハイマー病のリスク。 ナット-クリン-プラクト-ニューロール 2006;2:159-166.
22. Landreth G,Jiang Q,Madrekar S,et al. アルツハイマー病の治療のための治療薬としてのPPARgammaアゴニスト。 神経治療薬です 2008;5:481-489.
23. Lyn-Cook LE,Lawton M,Tong M,et al. 肝臓のセラミドはタイプ2の糖尿病および非アルコール性脂肪性肝炎の頭脳のインスリン抵抗性そして神経変性を仲介するかもしれません。 ジェイアール-ディス
24. トンM、デラモンテSM。 セラミドを介した神経変性のメカニズム。 ジェイアール-ディス
25., レーガー-マ、ワトソン-GS、グリーン-PS。 鼻腔内インスリンは認知を改善し、早期ADにおけるβ-アミロイドを調節する。 神経内科 2008;70:440-448.
26. Craft S.インスリン抵抗性症候群およびアルツハイマー病:記憶、アミロイドおよび炎症に対する年齢および肥満関連の影響。 ニューロビオールエイジング 2005;26(suppl1):65-69.
27. 江Q、ヘネカM、ランドレスGE。 アルツハイマー病におけるペルオキシソーム増殖剤活性化受容体ガンマ(PPARgamma)の役割:治療上の意味。 CNSの薬剤。 2008;22:1-14.
28. Watson GS,Cholerton BA,Reger MA,et al., ロシグリタゾンによる治療中の早期アルツハイマー病および健忘性軽度認知障害を有する患者における保存された認知:予備研究。 アム-ジェリアトル精神医学 2005;13:950-958.
29. Luchsinger JA,Mayeux R.Adiposityおよびアルツハイマー病. 2007年4月、127-134にてデビュー。
30. ホイットマー-ラー 肥満および認知症の疫学。 2007年4月、第117-122号に掲載された。
31. ワトソンGS、クラフトS.アルツハイマー病の病因におけるインスリン抵抗性の役割:治療のための含意。 CNSの薬剤。 2003;17:27-45.
32. コールGM、フラウチュシー SA。, 脳老化とアルツハイマー病におけるインスリンおよび神経栄養因子シグナル伝達の役割。 Expジェロントール 2007;42:10-21.
















コメントを残す