母体同種免疫の管理
原則として、1:32の臨界価まで連続母体抗体価をモニターし、胎児の水腫のリスクが高いことを示している。 この時点で、胎児は貧血および胎児の水腫の徴候について非常に強い監視を必要とする。, Kell alloimmunizationでは、hydropsは抑制された赤血球生成のために低い母体力価で起こることができ、したがって、1:8の力価が重要であると示唆されている。 したがって、デルタOD450値は、ケルアロイムニゼーションにおける疾患の重症度の予測においても信頼性が低い。
母体価は、最初の罹患した妊娠後の胎児貧血の発症を予測するのに有用ではない。 力価の大きい相違は異なった実験室の間の同じ患者で見ることができ新しいゲルの技術はより古い管方法より高い力価の結果を作り出します。, 従って、標準的な管の方法が重大な力価を定めるのに使用されるべきであり1つ以上の希薄の変更は母体抗体の力価の本当の増加を表します。 新生児の溶血性疾患(HDN)に関与するすべての抗体について、任意の抗体価の4倍の増加は、典型的には、胎児の評価を必要とする有意な変化と考えら
示された場合、羊水穿刺は、胎児遺伝子型を決定し、重症度を評価するために、妊娠15週(妊娠24週前の最初の影響を受けた妊娠ではめったに必要, 母体および父方の血液サンプルは、偽陽性の結果(母体偽遺伝子またはCcde遺伝子から)および偽陰性の結果(父親のRHD遺伝子座での再配列から)を排除するために、羊水サンプルと共に基準検査室に送られるべきである。母体血漿中の胎児Rh遺伝子型決定は、多くのヨーロッパ諸国において日常的になっており、米国で提供されている。, 胎児の細胞なしDNAは総循環の母体血漿DNAの3%を占め、妊娠の38日には早くもあり、胎盤があるcytotrophoblastの層のapoptosisから得られます。 循環胎児DNAの平均半減期は平均して30分未満であり、母体血漿は、試験前にすべての細胞要素を除去するために濾過および微小遠心に供される。 これにより、母体のリンパ器官における以前の妊娠の生着胎児細胞からの偽陽性の結果が排除される。,
無細胞胎児DNAは、RHD遺伝子特異的配列の存在のためのリアルタイムポリメラーゼ連鎖反応(PCR)に供され、症例の99.5%で正確であることが判明している。 SRY遺伝子(男性胎児における)および一般集団(女性胎児における)におけるDNA多型を、無細胞DNAの胎児起源を確認するための内部対照として使用する。 92一塩基多型(SNPs)のパネルは、バフィーコートと血漿から母親のサンプルとの間で比較されます。, 6つ以上のSnpの相違は胎児DNAの存在および女性の胎児のテストの妥当性を確認します。 最も望ましくなく、結果的である偽陰性の結果は、部分的または弱いD表現型によるものである。 これらは、少なくとも二つのRHD固有のエクソンプライマーを使用して検出され、重複で実行されます。 幸いなことに、c、C、e、EおよびKellのような他の赤血球抗原の遺伝子型を決定するための無細胞胎児DNA検査もまた、信頼性が高く正確であることが分,
連続羊水穿刺は、胎児の疾患の重症度を監視するために10-14日間隔で開始される。 すべての試みは、胎児出血(FMH)および抗体価のさらなる上昇につながる可能性のある針の経胎盤通過を避けるためになされるべきである。 連続デルタOD450の価値はQueenanの図表か延長Lileyの図表で胎児のhydropsの危険を評価するために計画される。 早期超音波検査は、正しい妊娠期間を確立するために行われます。, 胎児の健康を評価し、中等度の貧血および水腫の初期徴候を検出するために、頻繁な超音波検査モニタリングも行われる。
ピーク収縮期中大脳動脈(MCA)ドップラー速度は、胎児貧血を検出するための信頼できるスクリーニングツールであることが証明されており、羊水穿刺に代わっています。 MCAは色流れのドップラーと容易に視覚化されます;脈打ったドップラーが内部頚動脈からの分岐部にちょうど遠位ピークシストリック速度を測定するのにそれから使用されています。, MCA速度は妊娠期間の進行とともに増加するので,その結果は中央値(Moms)の倍数で報告される。 最近の研究では、中等度および重度の胎児貧血の検出に対する感度は100%であることが証明されており、偽陽性率は10%で1.5MOMであることが証明さ 羊水穿刺および臍帯穿刺のような侵略的な診断手順のための必要性を70%以上減らすことを示しました。
MCAドップラー研究は、早ければ18週の妊娠に開始することができますが、35週の妊娠後に信頼できません。, またそれに続く胎児の注入を時間を計り、対対対の注入のような多数の原因からの貧血症を、診断することを使用しました。 3週間の測定値からのMCA勾配は、重度の貧血の胎児リスクを予測するために使用されます(下の画像を参照)。
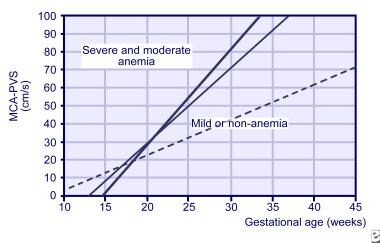 正常胎児(点線)、軽度の貧血胎児(細い線)、および重度の貧血胎児(太い線)の中大脳動脈(MCA)におけるピーク収縮期速度の勾配。,
正常胎児(点線)、軽度の貧血胎児(細い線)、および重度の貧血胎児(太い線)の中大脳動脈(MCA)におけるピーク収縮期速度の勾配。, MCAドップラー研究の経験の獲得により、胎児貧血を検出するための連続羊水穿刺がより少ない程度に使用されている。
子宮内腹膜輸血が唯一の治療手段であった期間中、新生児は妊娠32週で日常的に送達された。 このアプローチは硝子膜疾患および交換輸血の高い発生率をもたらした。, 子宮内での血管内輸血(IVT)の出現により、重度の影響を受けた胎児への一般的なアプローチは、妊娠35週まで必要に応じてIVTを行い、期間に予定されて これらの胎児では、輸血中の残血による羊水の汚染のために肺成熟の確立が困難であるが、妊娠34週前に送達が計画されている場合、胎児の肺成熟を高めるための母体ステロイド投与が示唆されている。,
さらに、過剰な羊水ビリルビンレベルは、蛍光脱分極TDx胎児肺成熟度試験、バージョンII(TDX-FLMII)に偽上昇を引き起こすため、赤外分光法、ラメラボディカウント、ホスファチジルグリセロール定量またはレシチン/スフィンゴミエリン(L/S)比など、胎児肺成熟度を決定するための他の試験を使用すべきである。
Lileyは1963年に腹腔内輸血(IPT)を最初に記述しました。 超音波ガイダンスの下で胎児腹膜腔にTuohy針を導入した。, 硬膜外カテーテルは、針を通してねじ込まれる。 放射線不透過性培地を胎児腹膜に注入する。 適切な配置は腸の外のまたはダイヤフラムの下の描写または胎児の腹水の拡散によって確認されます。,4日齢よりもss、o群、Rh陰性、ケル陰性、白血球還元、移植片対宿主病を予防するために25Gyを照射し、母体血清と交差マッチングを10mLのアリコートに以下の式で計算された体積に注入する:
IPT体積=(妊娠週数-20)×10mL
胎児における残留ヘモグロビン(hb)は、iptの適切な間隔および次の式による出産の妊娠の選択を可能にすると推定される:
hb g/dl=0。,85/125×a/b×120-c/120
式において、aは輸血されたドナーrbc Hbの量、bは推定胎児体重、cは輸血時からドナーhb推定時までの日数の間隔である。胎児Hbが10g/dLに低下したと推定されるとき、IPTが繰り返される。 通常、第二のIPTは、Hbを10g/dL以上に上昇させるために、最初の輸血の10日後に行われる。 その後、4週間ごとに、妊娠34-35週の予定納期まで別の輸血が行われます。, 胎児の横隔膜運動は、RBCの吸収が起こるために必要である。 このアプローチは瀕死のnonbreathing胎児のための価値ではないです。 母体の合併症には感染および経胎盤出血が含まれるが、胎児合併症には過輸血、失血、心タンポナーデ、感染、早産、および移植片対宿主病が含まれる。 IPT後の生存率は、超音波検査の助けを借りて約75%に近づいた。,
直接IVTは、より高い合併症の割合および水性胎児におけるIPTの有効性が限られているため、胎児介入の好ましい経路となっている。 ロデックは1981年にIVTを初めて成功させた。 超音波ガイダンスでは、胎盤またはその肝内部への臍帯挿入時に臍静脈に20-22ゲージの針を導入し、胎児の血液サンプルを得る。 血液サンプルは、迅速なアルカリ性変性試験によって胎児起源であることが確認される。, 関連する胎児検査(例,血液型,直接抗体検査,網状赤血球数,血小板数,Hbレベル,Hctレベル,血清アルブミンレベル,エリスロポエチンレベル)はすべて行われる。 Hbレベルが11g/dL未満の場合、またはHctレベルが30%未満の場合、IVTが開始されます。 針の位置は、生理食塩水の注射時に胎児血管内の乱流に注目することによって確認される。 胎児は頻繁にpancuroniumと麻痺し、胎児の動きによって針の変位を防ぐためにフェンタニル10mcg/kgを与えられます。, 母体の投薬は、局所麻酔薬のみから、日常的なインドメタシンおよび意識的鎮静、脊髄硬膜外鎮痛に至るまで様々である。
輸血は、超音波検査を用いて10-mLアリコートで約50mL/kgの推定体重の体積に、または40%のHctレベルに達するまで行われる。 超音波検査所見で心臓代償不全が認められた場合は,速やかに手術を中止する。, 重度の貧血の胎児は、Hctの正常値への急性矯正を許容せず、最初のIvtの時点で最初のHctを4倍以上増加させるべきではない。 それらはそれから2-7日毎に監視されるべきです。 IVTは、胎児の重大な貧血を反映する値に達したときに繰り返される。 一日あたりの輸血された細胞の1%の損失が予想され得る。
いくつかのセンターは、10日、2週間、および3週間ごとの間隔で繰り返し輸血を行う。 他のものは、0.4g/dL/日、0.3g/dL/日、および0の胎児ヘモグロビンの予想される減少に基づいて輸血する。,第一、第二、および第三の輸血間隔については、それぞれ2g/dL/日。 ピーク収縮期MCA速度は、1.32MOMの閾値で、第二の輸血を時間を計るために使用されています。 最初の子宮内輸血後、成人ヘモグロビンを有する赤血球の存在は赤血球生成を抑制し、酸素送達を改善し、これはピークMCA速度と胎児貧血の重症度との間の相関が悪い原因である。 いくつかのセンターは、輸血を繰り返す間隔にIVTとIPTを組み合わせた輸血の有益な効果を見出している。,
IPTの合併症に加えて、一時的な胎児徐脈、臍帯血腫、臍帯静脈圧迫、および胎児死亡がIVT中に報告されている。 但し、IVTに貧血症の即時の訂正および胎児のhydropsの決断、溶血およびそれに続く高インスリン血症の減らされた率、および頻繁に遅れる成長であるnonhydropic胎児のための胎児の成長の加速を含む多くの利点が、あります。 IVTは、瀕死の水産胎児および前胎盤を有する胎児に対して利用可能な唯一の介入である。 胎児の損失の危険はIVTの約0.8%対3です。,IPTのためのプロシージャごとの5%、および全生存率は88%です。
最近洗浄された母体Rbcは、まれな不適合の場合に抗原陰性Rbcの供給源としてうまく使用されているが、新しい赤血球抗原に対する感作リスクの低下、循環半減期が新鮮であること、ウイルス剤の感染リスクの低下などの利点のために日常的に使用されている。 母親は最初の妊娠後に赤血球の単位を寄付することができます。,
クイーナン曲線の患部における肺未熟度およびデルタOD450の場合、30mgのフェノバルビタールを一日あたり3回母親に経口投与し、その後一週間誘導すると、罹患した新生児における交換輸血の必要性が減少する。 最初の影響を受けた妊娠と以前に影響を受けた胎児を持つ母親の妊娠の管理のための優れたアルゴリズムは、Moiseによるレビューで概説されています(
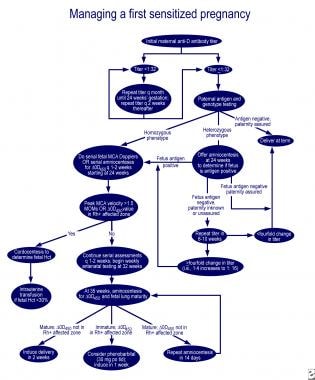 最初の影響を受けた妊娠の管理。,
最初の影響を受けた妊娠の管理。, 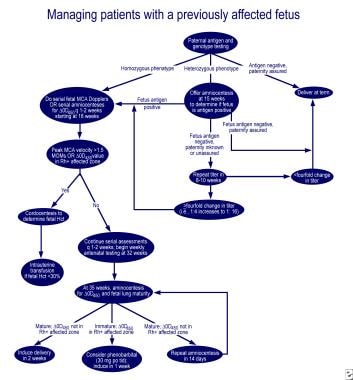 以前に影響を受けた胎児を持つ妊婦の管理。
以前に影響を受けた胎児を持つ妊婦の管理。 Rhハプテン、Rh陽性RBC間質、およびプロメタジンの投与によるRh抗体産生を抑制する最初の試みは失敗した。 5%アルブミン(治療的血漿交換)および静脈内免疫グロブリン(IVIG)または毎週1g/kg体重でのIVIGの投与を用いた部分置換を伴う広範な血漿交換は、適度に有効であることが示されている。, 作用機序は胎盤におけるFc受容体の閉塞,胎児への抗体輸送の減少,胎児細網内皮系における食細胞上のFc受容体,および母体抗体合成のフィードバック阻害であると考えられる。 しかし,血しょう交換後に抗体依存性細胞媒介細胞毒性および抗体濃度のリバウンド上昇,処置中の胎盤血流の変化および産後出血が認められている。,
RBC同種免疫による重度のHDFNを有する5人の妊婦を含むより最近のレトロスペクティブ研究は、妊娠初期の治療血漿交換、IVIG、および子宮内輸血(IUT)の組み合わせ 女性は3週間妊娠の10-13の間に血漿交換手順を受け、毎週IVIG注入によって、胎児は完全にd、C、E、K、Fy、Jk、およびS抗原群に母親の表現型に一致するRBCユニットを受け取った。 すべての女性は33-38週の妊娠で健康な幼児を配達しました。,
しかし、これらの技術は、これらの手順がより許容可能なリスクで行うことができる妊娠20-22週まで、経皮的umbilical血サンプリング(PUBS)およびIVTの必要性 IVIGの使用のレビューは、胎児水腫の発症を予防し、IUTの必要性を遅らせることにおけるその有用性を示している。, したがって、その週に12週の妊娠3回から始まり、第三回の血漿交換後に2g/kgの負荷用量でIVIGを続け、その後1g/kg/wkを妊娠20週まで継続する血漿交換の併用アプローチは、妊娠20週前のリスク胎児に対して提案されており、IVTが行えない場合や水腫がIVTに反応しない場合にも妊娠後に使用することができる。,
ある報告では、IVTを用いた重度の同種免疫化を伴う胎児の治療と、第三のIVTから始まる1g/kg/用量での胎児IVIG療法を組み合わせることが、IVTの頻度を減らし、水腫の徴候を改善するのに役立ったことが示された。 症例報告は、胎児の腹腔内IVIG注射2g/kgによる抗M抗体による同種免疫化を伴う胎児における重度の貧血および水腫の治療に成功したことを示している30週間から毎週与えられた。 しかし、これは症例報告であり、これが治療の標準になる前に無作為化比較試験が必要である。,
同様の検査および治療レジメンは、抗Rhc、抗K(K1)、および抗Mなどの非rhd同種免疫によって影響を受ける妊娠の管理に使用される。 母体力価は、胎児貧血の閾値に達するまで(妊娠28週まで毎月、その後2週ごとに)繰り返される(ケルの場合は1:8、休息の場合は1:32)。,
胎児の抗原タイピングは、父親がヘテロ接合であることが判明した場合、母体血漿中の羊水穿刺または無細胞胎児DNAを介して行われる(100%K1、65%M)。 胎児が抗原陽性であることが知られている場合は、重度の胎児貧血のサーベイランスが行われ、早くも16-18週には毎週MCAドップラースクリーニングが行われ、妊娠1.5週を超える場合は妊娠38週までに分娩が行われる。
父性白血球に対する母体同種抗体は、Fc遮断をもたらし、胎児溶血性貧血の重症度を低下させることが示されている。, これは将来的に使用される可能性があります。
感作新生児の管理
軽度の溶血性疾患は、直接抗体検査の結果が陽性である新生児の50%を占める。 これらの新生児のほとんどは貧血ではなく(臍帯ヘモグロビン>14g/dL)、溶血が最小限である(臍帯ビリルビン<4mg/dL)。 初期の光線療法とは別に、輸血は必要ありません。 但し、これらの新生児は生命の3-6週までに厳しく遅い貧血症を開発する危険がある状態にあります。 したがって、退院後のHbレベルを監視することが重要です。,
中等度の溶血性疾患は、罹患した新生児の約25%を占める。 新生児の中等度の溶血性疾患は、中等度の貧血および臍帯ビリルビンレベルの増加を特徴とする。 これらの幼児は生れで臨床的に黄疸がないが、生命の最初の24時間のunconjugated hyperbilirubinemiaを急速に開発します。 末梢塗抹標本は、多数の有核赤血球、血小板の減少、および時には多数の未熟granul粒球を示す。, これらの新生児はしばしば肝pl腫を有し、適切な治療を受けずにビリルビン脳症を発症する危険性がある。 集中的な光線療法を伴うO型Rh陰性新鮮な赤血球による早期交換輸血が通常必要である。 単回用量または複数回用量レジメンにおける0.5-1g/kgの用量でのIVIGの使用は、交換輸血の必要性を効果的に低減することができた。,
前向き無作為化比較研究は、光線療法および入院期間を短縮し、中等度から重度のRh等免疫化を伴う新生児における交換輸血を防ぐために、1歳の12時間で早期の高用量IVIG/kgを示している。 これらの新生児は、生後4-6週間で幼児期の後期高進性貧血を発症するリスクもあります。 しかし、ある無作為化二重盲検プラセボ対照試験では、予防的IVIG療法の利点を示すことができませんでした0。,75G/kg Rh等免疫のための子宮内輸血で治療された重度の影響を受けた新生児における年齢の4時間以内に。
重度の溶血性疾患は、出生時に死産または水分摂取のいずれかである同種免疫された新生児の残りの25%を占める。 胎児水腫は,主に組織低酸素症による毛細血管漏出症候群,肝機能障害に続発する低アルブミン血症,貧血による高出力心不全によって引き起こされる。, これらの胎児の約半分は、34週間の妊娠前にhydropicになり、前述のようにalloimmunized妊娠の集中的な監視と管理を必要とします。 腹水を含む穏やかな水腫は改善された存続のケースの88%だけでIvtと逆転しますが、頭皮の浮腫および厳しい腹水および胸水を引き起こす厳しい水腫はケースの39%で逆転し、悪い存続と関連付けられます。
ABO非互換性の管理
高ビリルビン血症の管理は、ABO非互換性を有する新生児における主要な関心事である。, 交換輸血および光線療法の基準は、Rh同種免疫で使用される基準と同様である。 IVIGはまた、コースの早期に投与された場合にも非常に有効であった。 スズ(Sn)ポルフィリンヘムオキシゲナーゼの強力な阻害剤であり,ヘムからのビリルビンの産生における律速段階を触媒する酵素であり,ビリルビンの産生を減少させ,ABO不適合を有する新生児における交換輸血の必要性および光線療法の持続時間を減少させることが示されている。
スズまたは亜鉛プロトポルフィリンまたはメソポルフィリンは新生児で研究されている。, それらは体重に基づいて用量で筋肉内に投与されなければならず、その有効性はすべての妊娠において関連する用量であるように見える。 それらの可能性のある毒性作用には、皮膚の光増感、鉄欠乏、および一酸化炭素の産生の阻害が含まれる。 新生児のRh溶血性疾患におけるそれらの使用は報告されていない。 定期的な使用は長期安全データの欠乏のためにまだ推薦することができません。
















コメントを残す