はじめに
葉緑体は植物細胞の構造的特徴を表し、それらの一次代謝と高レベルの機能を介して植物の生存をサポートする(Kirk and Tilney-Bassett,1978;Mullet,1988;López-Juez and Pyke,2005)。 植物の栄養成長の間、葉細胞は、サイズおよび形状に関して非常に均質な葉緑体集団を含む。, 細胞あたりの葉緑体の数は、既存の細胞小器官の二分裂及び細胞分裂中に二つの娘細胞に分割することによって達成される(Birky、1983;Possingham及びLawrence、1983)。 したがって、与えられた細胞型における葉緑体数の調節は、葉緑体の細胞機能および遺伝的継承にとって重要である。
植物細胞における葉緑体数決定の性質を調べるために、代表的な種の葉肉細胞が大きな役割を果たしてきた。, これらの細胞は光合成にとって生理学的に重要であり、高度の構造的および機能的均一性を示す。 単離された組織および細胞の初期の系統的観察による分析(Boasson and Laetsch,1969;Possingham and Saurer,1969;Boffey et al.,1979;Lamppa et al.,,1980;Thomas and Rose,1983;Pyke and Leech,1991)は、葉緑体(色素体)は合成されず、分裂によって複製されるという概念や、葉肉の葉緑体数が様々な環境および植物内因性因子に敏感であるという観察を含む、葉緑体数の決定に関する多くの有用な情報を提供した。 後者に関しては、ホウレンソウでは、光は薄暗いまたは暗い条件と比較して、葉円板培養中の葉緑体分裂にプラスの影響を及ぼす(PossinghamおよびLawrence、1983)。, 小麦の最初の葉では、細胞容積は葉緑体増殖と正の相関がある(Ellis and Leech、1985;Pyke and Leech、1987)。 最初の葉の細胞あたりの平均葉緑体数は、Landsberg erecta(Ler)エコタイプで121、Wassilewskija(Ws)エコタイプで83である(Pyke and Leech,1994;Pyke et al., 1994)., 葉肉細胞はまた、葉緑体分裂の遺伝的制御の理解に貢献しており、例えば、葉緑体増殖に障害された変異体をスクリーニングし、葉緑体分裂に関与する遺伝子機能を特徴付けることにより、葉緑体分裂機械構成要素または葉緑体調節因子をコードする20以上の遺伝子が明らかになった(Gao and Gao,2011;Miyagishima et al.,2011;Basak and Møller,2013;Osteryoung and Pyke,2014;Li et al., 2017).
対照的に、非葉肉細胞における葉緑体の複製に関する研究(例えば,、葉表皮における舗装細胞;Itoh et al.,2018)は不足している。 最近、葉緑体分裂の調節は、葉組織間で異なることが報告されている(Fujiwara et al.,2018;Itoh et al.,2018)、詳細なメカニズムは不明のままである。 さらに、タバコおよびシロイヌナズナのシュート頂端分裂組織および葉原始細胞における懸濁培養BY-2細胞および葉葉肉プロトプラストの解析(Nebenführ et al.,2000;Sheahan et al.,,2004;Seguí-Simarro and Staehelin,2009)は主要な洞察を提供しているが、植物において葉緑体(色素体)の分配がどのように調節されているかはまだ不明である。 したがって、かなりの努力にもかかわらず、葉緑体研究における基本的な問題は、(i)植物組織における細胞当たりの葉緑体数はどのように調整されているか、(ii)細胞分裂における葉緑体分割はどのように調節されているかなどである。,
ガード細胞の葉緑体数に関する研究の歴史
シュート表皮における気孔Gcは、一般的に葉緑体を含み、葉肉と大気との間のガス交換を制御する(Sachs、1875;Taiz et al.,2015;図1A参照)。 葉中のGC葉緑体数の最初の調査は、自然に栽培されたショウジョウバエ植物(Macfarlane、1898)で一世紀以上前に行われました。, 他の植物および細胞構造的特徴と同様に,DroserafiliformisとDroseraintermediaの交配に由来する推定雑種における細胞当たりのGC葉緑体数は両種間の中間であり,GC葉緑体数は植物の遺伝的構成を決定するために使用できることを示唆した。 その後、植物種間のGC葉緑体数の違い(Sakisaka、1929)および桑の葉表皮におけるGCsにおける比較的安定した葉緑体数(Morus spp)について重要な観察が報告された。,;Hamada and Baba,1930)およびいくつかのアブラナ属の成熟した葉(Iura,1934)。 さらに、自己倍数体テンサイ(ベータ尋常性)植物の分析により、葉中のGC葉緑体数は植物の核倍数レベルと正の相関があることが明らかになった(望月-末岡、1955)。 その後、さまざまな植物サンプルを用いて、葉緑体数と気孔サイズと倍数性レベルとの関係を調べるために、より詳細かつ包括的な分析を行った(例えば、Frandsen、1968)。, これらの分析では、気孔(GC対)レベルでの葉緑体カウンティングが頻繁に採用され、対のGc間の葉緑体分布の偏りの影響を排除し(例えば、望月と末岡、1955;Frandsen、1968)、約80種、変種、雑種の葉または子葉の平均GC葉緑体数は、二倍体で2.8から40.0(2×)、四倍体で5.0から73.5(4×)であったことが明らかになった。 また、植物における全ゲノム重複イベント(すなわち、1×から2×、2×から4×など)。)により約1,高忠実度のGC葉緑体数の7倍の増加(Butterfass、1973でレビュー)。 これらの結果は、化学(例えば、コルヒチン)または放射線療法(例えば、Jacobs and Yoder、1989;Singsit and Veilleux、1991;Qin and Rotino、1995)と組み合わせて、組織培養、交雑、または自然栽培によって得られたさまざまな組織および植物における倍数性レベルに関する調査を奨励した。, GC葉緑体数は気孔生物学(Lawson、2009)および細胞学において葉緑体の増殖を理解するために研究されているが(Butterfass、1979;下記参照)、それは主に雑種、種、および変異体の検出および標的植物組織の倍数性レベルの推定のための信頼できる便利なマーカーとして役立っている。
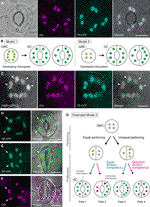
図1気孔ガード細胞(GCs)における葉緑体数の制御のための単純化されたモデルおよび顕微鏡証拠。, トランジットペプチド(TP)とシアン蛍光タンパク質(CFP;TP-CFP)とのストーマ標的融合を発現するシロイヌナズナ葉葉の軸表皮における典型的なストーマ(GC対)。 (B)ガード母細胞(GMCs)からのGC開発中に葉緑体パーティショニング(モデル1)または葉緑体増殖とパーティショニング(モデル2)のいずれかを含むGCsにおける葉緑体数決定の二つのモデル。 (C)TP-CFPとFtsZ1を発現するシロイヌナズナ葉の葉柄のadaxial表皮におけるGC対は、緑色蛍光タンパク質(GFP;FtsZ1-GFP)に融合した。, 黄色蛍光蛋白質(YFP;TP–YFP)に融合したTPの発現を有する(D,E)または有さない(F)シロイヌナズナ葉葉の軸表皮における(d-F)GC対。 (F)葉緑体マーカーとしてクロロフィル自家蛍光(Chl)を用いた。, (G)拡張モデル2,等しいと等しくない葉緑体パーティショニングの関与を表すGMC分割と等しいとGC葉緑体のその後の分割(青線)または選択的(赤線)分割能力,葉緑体数決定の四つのタイプになります(運命1-4)シロイヌナズナの葉の後期気孔発達中に. (A,C-F)蛍光顕微鏡は、前述したように植物材料を用いてOlympus IX71倒立顕微鏡を用いて行った(Fujiwara et al.,2017,Fujiwara et al., 2018)., クロロフィル、CFP、GFP、およびYFPの蛍光シグナルは、それぞれマゼンタ、シアン、緑(マージされた画像のみ)、および緑で擬似着色されています。 パネルの徴候は次の通りあります:矢頭、FtsZ1リング;矢、拡大されたGCの葉緑体;破線、細胞の形。 スケールバー=10μm。
葉緑体数制御の分析のための葉ガード細胞の有用性
葉葉肉細胞は、長い葉緑体数の分析のための主要なモデルとして採用されてきた。, それらは葉緑体分裂に対する環境条件の影響の研究には利点があるが(例えば、光サイトカイニンシグナル伝達;Boasson and Laetsch,1969;Possingham and Lawrence,1983;Okazaki et al.,2009;Chiang et al.,2012)、彼らはいくつかの点で制限されています。 第一に、葉肉細胞は大きさや形が異なり、葉の奥深くに分布しているため、無傷の組織を操作することが困難です。, 第二に、環境ストレスおよび植物の成長条件に対する葉肉葉緑体の増殖の感受性は、研究間の信頼できる比較を防ぐことができる。 シロイヌナズナコロンビア(Col)エコタイプにおける細胞当たりの葉肉葉緑体数は、76(Kinsman and Pyke,1998)、80-100(Stokes et al.,2000),70(Tirlapur and König,2001),41(Yoder et al.,2007),40-60(Okazaki et al.,2009)、および30-40(Kawade et al., 2013)., さらに,葉発育中の葉肉細胞当たりの最終葉緑体数に対する葉緑体分割の寄与を評価することはほとんど不可能であるが,これは細胞分裂速度と葉緑体分裂速度のバランスによって決定されると考えられる。 植物葉細胞における葉緑体数制御のメカニズムを明らかにするためには、上記の問題を克服するモデルシステムが必要です。
気孔Gc(図1A参照)は、葉緑体数制御のメカニズムを理解するためのモデルシステムの特性を示しています。, GCsは、組織内のサイズおよび形状が非常に均一であり、シュートの最外層におけるそれらの散在しているが密な分布は、光および蛍光顕微鏡によるそれらの検出を容易にする。 Gcはまた、シュート頂端分裂組織の原胚葉細胞または胚性表皮細胞に由来し、分裂組織モイド(分裂組織活性を有する気孔前駆体)およびガード母細胞(Gmc;GC対の前駆体)を通したそれらの発達配列が詳細に確立されている(Zhao and Sack,1999;Nadeau and Sack,2002;Kalve et al., 2014)., 後期気孔の開発は、葉緑体分布と細胞質分裂の前後のパーティショニングの評価を可能にする対称GMC部門の単一のラウンドを含みます。 実用的な実験の観点から、葉Gcは顕微鏡検査に適している。 Sinapis albaの葉Gcにおける細胞当たりの葉緑体数は、葉肉細胞におけるそれよりも異なる光条件の影響を受けにくいことが以前に示されていた(Wild and Wolf、1980)。, さらに,葉柄におけるGC葉緑体数の差は,Col,Ler,Wsの三つのシロイヌナズナ生態型の間で比較的小さい(藤原ら。, 2018). さらに、葉肉、舗装細胞、およびトリコーム細胞の発達に影響を与えるendoreduplicationは、シロイヌナズナの葉Gcsでは検出されていない(Melaragno et al.,1993)、これは細胞の2Cレベルでの葉緑体数データの解釈を保証するであろう。, これらの報告は,葉Gcsが特定の細胞系列における葉緑体数ダイナミクスの系統的解析のための優れたモデルである可能性があることを示唆している。
葉緑体数の制御を研究するためのモデルとしてのシロイヌナズナ葉ガード細胞
GC葉緑体研究の歴史において、気孔(GCペア)レベルでの葉緑体計数は、個々のGCレベルでのカウントとして葉緑体数を決定する上で同様に重要な役割を果たしてきた。 どちらの方法も同じ平均葉緑体数を生成する(Butterfass、1973)。, 対GCsにおける葉緑体分布の変化とその根底にあるメカニズムが焦点を当てている場合、葉緑体の個々の細胞レベルでの詳細な情報、すなわちその大きさ、形状、および細胞内局在が不可欠である。 GMC–GC分化中の葉緑体(色素体)増殖は、以前にいくつかの植物種(Butterfass、1973、Butterfass1979)で調べられた。, これらの研究は、異なる植物種におけるGCsの末端葉緑体数を決定するための二つのモデルを提案した(図1B):一つ(モデル1;テンサイ)は、GMC分裂で葉緑体分配のみを含み、もう一つは葉緑体分配だけでなく、GC発生中の葉緑体増殖も含む。
分子遺伝学、ゲノミクス、細胞イメージング、および他の学際的な分析の時代には、葉緑体分配機構のさらなる特性評価のための多くの可能性がある。, シロイヌナズナ葉Gcsはこの目的のための最良のモデルシステムの一つである可能性がある。 いくつかの研究では、シロイヌナズナの葉または子葉におけるGC葉緑体数を調べた(Hoffmann、1968;Pyke and Leech、1994;Pyke et al.,1994;Robertson et al.,1995;Keech et al.,2007;Chen et al.,2009;Yu et al.,2009;Higaki et al.,2012;Fujiwara et al., 2018). これらのGcは、平均して3.5から5.5までの範囲の葉緑体の適度な数を示します。 これまでに、気孔発達中の葉緑体(色素体)数の変化を調べた研究はなかった。, しかしながら、気孔発達分析からの顕微鏡的証拠(例えば、ZhaoおよびSack、1999;Hachez et al.,2011)および我々の予備的な観察は、GMCsがGCsよりも発生する葉緑体の数が少なく、葉緑体の増殖がGC分化中に起こる可能性があることを示している。 これを試験するために、緑色蛍光タンパク質に融合したプローブFtsZ1(FtsZ1-GFP)を用いて、GCsにおける葉緑体分裂機構の形成をモニターした(Fujiwara et al., 2008)., 間質およびFtsZ1環をそれぞれ視覚化するために、トランジットペプチド(TP)-融合CFPおよびFtsZ1-GFPを同時に発現するトランスジェニックラインを、エピ蛍光, 2017). 拡大する葉の葉柄(4週齢の苗の第五の葉)を用いた。 その結果、葉緑体が対称的に収縮するGCsが検出された(図1C)。 これらの葉緑体は、葉肉および舗装細胞の内側エンベロープ膜の間質表面に葉緑体分裂リングであるFtsZ1リングを形成した(Vitha et al.,2001;Fujiwara et al.,,2008)、赤道狭窄部位にある。 シロイヌナズナの葉の発達における気孔パターニングと一致する(Donnelly et al.,1999;Andriankaja et al.,2012)、葉緑体を分割することは、葉の拡張の後期および早期の段階で検出された。 したがって、モデル2は、シロイヌナズナの葉GCsに最も適している可能性が最も高い。
シロイヌナズナ葉ガード細胞における葉緑体の増殖と拡大の関係
さらに、GC葉緑体形態形成の予期しない表現型が成熟したGCsで観察された(図1D、E)。, TP融合黄色蛍光タンパク質(YFP)ラインから完全に拡張された葉(4週齢の苗の第三–第四の葉の葉)の表皮皮を顕微鏡的に特徴付けたとき(FL6-5ライン;藤原ら。,2018)、いくつかの気孔はGC対で不均等な葉緑体分布パターンを示したが、ほとんどの葉の気孔は等しいまたは類似した葉緑体分布パターンを示した(Robertson et al.,1995;Fujiwara et al., 2018)., ストーマのGCペア内では、より小さな数の葉緑体を含むGCの葉緑体のサイズは、より大きな数の葉緑体を含むペアの他のGCsよりも大きかった(図1D、E)。 このようにして、Gcsはおそらく細胞増殖中に細胞当たりの総葉緑体容積を一定のレベルに維持する。 拡大した葉緑体は末端表現型を表し,拡大した葉ではもはや分裂できなかった。 これらの結果は、間質標識のためのTP融合蛍光タンパク質の発現に関係なく、いくつかの独立した実験で確認された(図1F)。,
このGC葉緑体表現型は、葉緑体分裂の制御に欠陥のある葉肉細胞において十分に文書化された葉緑体拡張の補償機構として解釈される(Pyke and Leech,1994;Pyke et al., 1994). 今日まで、小麦の葉肉細胞における葉緑体数と葉緑体サイズとの間に負の相関が報告されているのは一つの研究(Ellis and Leech、1985)のみであり、多くの研究では正常な葉肉細胞における細胞体積と葉緑体数との間に正の相関が報告されている(Leech and Pyke、1988;Pyke、1997)。, 一方、GC葉緑体数の不均衡は低頻度で起こる(Fujiwara et al.,2018)は、GC対における葉緑体の不均一性は、対称的な細胞分裂にもかかわらず、シロイヌナズナの野生型葉細胞間の葉緑体の分化を引き起こす可能性があることを示している。
GCsにおける葉緑体補償効果は、葉肉細胞よりも厳密ではない可能性がある。, Gcsは、シロイヌナズナarc6およびatminE1およびtomato suffultaのような著しく障害された葉緑体分裂変異体において、細胞当たりの全葉緑体容積の不足または完全,1995;Forth and Pyke,2006;Chen et al.,2009;Fujiwara et al., 2018)., 後期葉緑体分裂変異体arc5では、GC葉緑体数の減少は、葉肉細胞とは異なり、葉緑体サイズの有意な増加とは関連していなかった(Pyke and Leech、1994)。 葉肉細胞よりもGcsにおける葉緑体拡張の程度が低い(Pyke and Leech,1994;Barton et al.,2016)、およびGc間の葉緑体拡張の変化は、GCあたりの総葉緑体容積のような広い許容範囲の根底にある可能性がある。, さらに,GMC–GC分化中の葉緑体分裂のタイミングは末端GC葉緑体表現型に有意に影響すると考えられた。 この問題に対処するためにはさらに詳細なキャラクタリゼーションが必要であるが,シロイヌナズナの葉Gcsは植物細胞における葉緑体数制御の未開発の側面を調べるためのシステムを表していると考えられる。,
シロイヌナズナ葉ガード細胞における葉緑体数決定のためのワーキングモデル
上記に基づいて、我々はgcsにおける葉緑体数の解析のためのワーキングモデル(拡張モデル2)を提案する(図1G)。 GCあたりの最終的な葉緑体数は、GMC分裂における葉緑体分配およびGcsにおける葉緑体増殖によって決定される。 GMC分裂の間、葉緑体は等しいまたは等しくない分割を受けることがある。 葉緑体の増殖の間、GC葉緑体は等しい(青い線)または選択的な(マゼンタ線)分裂能力のいずれかで増殖する。, 例えば、等しく分割された葉緑体が等しい分割能力を有する場合、等しい葉緑体数はGC対において生じる(Fate1)。 不均等に分割された葉緑体が同等の分裂能力を有する場合、葉緑体はGCペア内で同じ速度で増加する(Fate3)。 Gcsで選択的な葉緑体分裂が起こると、GMC分裂後にGCペアの葉緑体数のバランスが変化する(運命2と4)。, 現在、”選択的葉緑体分裂”の支持を見つけることは困難ですが、運命1と4が実際にGCsで優勢であれば、葉肉細胞のように細胞当たりの総葉緑体容積を制御するメカニズムを持っている可能性があります。 このモデルは二つの問題を提起する:(i)GC葉緑体は娘細胞に適切に分配されており、どのように分配されているか? そして、(ii)GC葉緑体の分割能力は調整されていますか?,
問題(i)に関して、葉緑体の遺伝が細胞質内の複数の葉緑体のランダムな分布によって起こるのか、または陽性葉緑体分配機構によって起こるのかは、長い間懸念されている(Butterfass、1969;Birky、1983;Hennis and Birky、1984;Nebenführ、2007;Sheahan et al., 2016). 興味深いことに、シロイヌナズナarc6では、葉または子葉Gcはゼロから三つの葉緑体を有し、葉緑体欠損Gcでは、非光合成色素体はまだ小胞から細長い形,1995;Chen et al.,2009;Fujiwara et al., 2018)., Arc6では色素体自体を欠いたGcは見つかっておらず、葉緑体分割装置の破壊にもかかわらず、これについての説明はない(Vitha et al., 2003). したがって、気孔系列研究におけるarc6葉緑体の複製と形態を調べることが重要である。 シロイヌナズナ変異研究はまた、この問題のための別の手がかりを与える, しわくちゃ葉(crl)変異体における子葉GCsの18%は細胞質に色素体構造を含まないが、葉肉細胞の100%は一から四の拡大した葉緑体を含むという観察(Asano et al.,2004;Chen et al.,2009)は、非常に重要です。 CRLは、未知の機能を持つ葉緑体外側エンベロープタンパク質である。 CRLタンパク質機能を理解することは、葉緑体分割のメカニズム(複数可)に洞察を提供することができます。, シロイヌナズナアーク変異体および他のトランスジェニック系統における葉葉肉細胞における葉緑体の増殖および分配の解析は、非葉肉色素体の増殖および分配に関する研究を促進した。 同様に、Gcsで得られた結果は、他の細胞系に移入可能であり得る。
最後の発言
GCモデルは、葉緑体生物学の発展のための多くの見通しを開きます。 例えば、細胞骨格系は葉緑体の形態、運動、および仕切りを調節することが知られているが(Sheahan et al.,,2016;Wada,2016;Erickson and Schattat,2018)では、植物における葉緑体の増殖および分配における各調節遺伝子の役割はほとんど注目されていない。 一方,種々の実験的戦略によってGC葉緑体数や形態を損なうことが可能になれば,気孔系列細胞における葉緑体形態形成の分子制御に関する新しい洞察が提供される可能性がある。 さらに、気孔発達中の葉緑体数の定量分析と組み合わせて、数学的モデリングは、これらの調査のための新しい道を提供するかもしれません。, GC葉緑体数がどのように制御されているかについての現在の知識を提示し,葉緑体の増殖と分割を理解するためのシロイヌナズナ葉Gcsの潜在的な有用性を強調した。
データ利用可能性に関する声明
この研究のすべてのデータセットは、記事/補足資料に含まれています。
著者の貢献
MFは研究を考案し、原稿を書いた。 MFおよびASは実験を行った。 ASおよびRIは分析を行った。 すべての著者は、最終的な原稿を読んで承認しました。,
資金調達
この作業は、文部科学省によって科研費(MFに助成金19k05831、RIに助成金18K06314)の下で支援されました。
利益相反
著者らは、この研究は、潜在的な利益相反と解釈され得る商業的または財政的関係がない場合に行われたと宣言している。
謝辞
著者は、仕事に関するアドバイスのために神沢信之博士(上智大学)に感謝します。
Birky,C.W.,Jr.(1983)., 細胞分裂における細胞質オルガネラの分割。 イント サイトールさん 15, 49-86.
Google Scholar
バターチャーン、T.(1969)。 一倍体スウェーデンクリー(Trifolium hybridum L.)の閉鎖細胞母細胞の有糸分裂における色素体分布。 プランタ84 230-234 doi:10.1007/BF00388108
PubMed Abstract|CrossRef Full Text|Google Scholar
butter churn,T.(1973). 核DNA量による色素体分裂の制御。 原形質76、167-195。 土井:10,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., タバコ葉肉プロトプラスト培養および植物再生に関連する色素体数および色素体構造変化。 プランタ158 329-338 doi:10.1007/BF00397335
PubMed Abstract|CrossRef Full Text|Google Scholar
Tirlapur,U.K.,König,K.(2001). シロイヌナズナの生きている束鞘細胞における葉緑体分裂の非侵襲的なリアルタイムresolution解能タイムラプスイメージングのための新しいツールとしてのフェムト秒近赤外線レーザー。 214件中1-10件目 土井:10,1007/s004250100597
PubMed Abstract|CrossRef Full Text|Google Scholar
Wild,A.,Wolf,G.(1980). Sinapisalbaの一次葉の個体発生における葉肉およびガード細胞における葉緑体の気孔の頻度および大きさ,細胞の大きさ,数,大きさおよびクロロフィル含量に対する異なる光強度の影響を調べた。 Z.Pflanzenphysiol. Bd。 97, 325–342. doi:10.1016/S0044-328X(80)80006-7
CrossRef Full Text|Google Scholar
















コメントを残す