温度が上昇するにつれて、酵素反応の速度も上昇する。 温度の十の摂氏度の上昇は50%から100%ほとんどの酵素の活動を高めます。 1度または2度の小さな反応温度の変化は、結果に10%から20%の変化をもたらす可能性がある。 この増加は、高温が酵素の構造を破壊するまで、ある時点までのみである。 酵素が変性すると、それを修復することはできません。, それぞれの酵素はその構造やアミノ酸とペプチドとの結合が異なるため、変性温度はそれぞれの酵素に特有です。 ほとんどの動物酵素は40℃以上の温度で急速に変性するため、ほとんどの酵素の決定はその温度よりもやや低い温度で行われます。
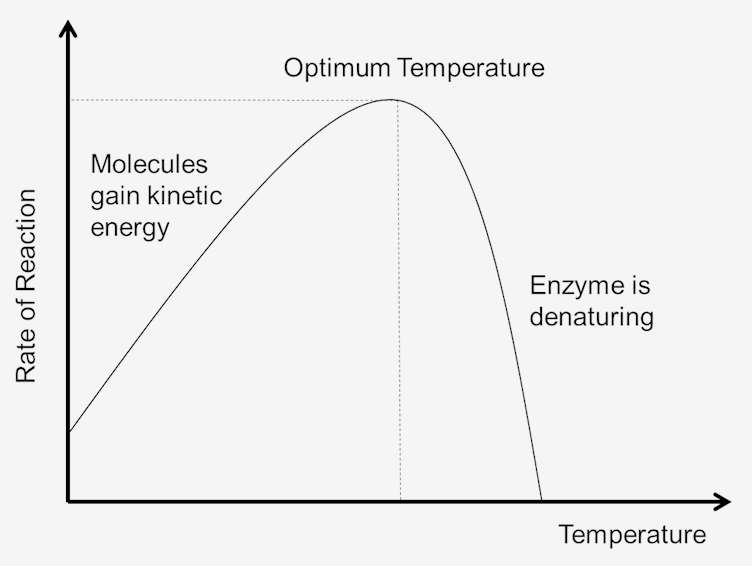 図1. 反応速度に対する温度の影響。
図1. 反応速度に対する温度の影響。
一定期間にわたって、酵素は適当な温度で不活性化されます。 一般に、5℃以下での酵素の貯蔵が最も適している。 より低い温度はより遅い化学反応をもたらす。, 酵素は結局凍結温度で不活性になりますが、温度が再び上昇すると酵素活性のほとんどを回復しますが、一部の酵素は凍結すると活性を失います。
運動エネルギーと内部エネルギー
系の温度は、ある程度系内の分子の運動エネルギーの尺度である。 すべての分子間の衝突は温度が上昇すると増加する。 これは、温度の上昇に続く速度および運動エネルギーの増加によるものである。 速い速度では、衝突間の時間が短くなります。, これは反作用の率を高める活発化エネルギーに達するより多くの分子で起因します。 分子もより速く動いているので、酵素と基質との間の衝突も増加する。 したがって、運動エネルギーが低いほど、システムの温度が低くなり、同様に、運動エネルギーが高いほど、システムの温度が高くなります。
系の温度が上昇するにつれて、系内の分子の内部エネルギーが増加する。, 分子の内部エネルギーには、分子の並進エネルギー、振動エネルギーおよび回転エネルギー、分子の化学結合に関与するエネルギー、ならびに非結合相互作用に関与するエネルギーが含まれ得る。 この熱の一部は、化学ポテンシャルエネルギーに変換され得る。 この化学ポテンシャルエネルギーの増加が十分に大きければ活動的な蛋白質の三次元形状を定める弱い結束のいくつかは壊れるかもしれません。 これは蛋白質の熱変性の原因となり、こうして蛋白質を不活性化できます。, したがって、あまりにも多くの熱は、酵素または基質が変性および不活性になるため、酵素触媒反応の速度を低下させる可能性がある。
最適温度
各酵素は、最大反応速度が達成される温度範囲を有する。 この最大値は、酵素の温度最適として知られています。 ほとんどの酵素にとって最適温度は華氏98.6度(摂氏37度)です。 より低く、より高い温度でよく働く酵素がまたあります。, 例えば、北極動物はより低い最適温度に適応した酵素を有し、砂漠気候の動物はより高い温度に適応した酵素を有する。 しかし、酵素はまだタンパク質であり、すべてのタンパク質と同様に、華氏104度以上の温度で分解し始めます。 したがって、酵素活性の範囲は、酵素が活性化し始める温度およびタンパク質が分解し始める温度によって決定される。,より多くのサービス細部を論議するためには、1-631-562-8517を呼ぶか、またはで私達を電子メールで送ることによって私達に連絡して下さい[email protected].
















コメントを残す