| シェフィールド大学 | |
| 化学科 | VSEPR |
アンモニアはまた、四つの電子対を有し、窒素の配位幾何学は電子対の四面体配置に応じて。 三つの結合基があるだけであり、したがって一つの孤独な対があります。 しかし、孤立対は”見えない”ので、アンモニアの形状はピラミッド型である。,r>
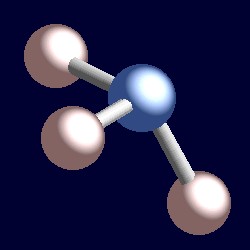
電子の結合対を考えてみましょう。 二つの電子は二つの核の間に位置し、両方によって引き付けられる。 孤独なペアは異なります。 それは必然的に一つの核にのみ引き寄せられ、その結果、それは電子の結合対よりもその一つの核に効果的に近い位置を採用することである。 これは、孤立電子対が占有する有効な立体角が結合対が占有する有効な立体角よりも大きいことを意味する。, 孤立電子対はより大きな角の部屋を必要とし、結合対よりも原子に近い位置にある。 アンモニアに対するこの結果は、孤立電子対が三つの水素原子を少し一緒に押すことによってそれ自身のための余地を作り、H-N-H結合角は106.6°の理想的な四面角よりもわずかに小さい(109.5°)ことである。
© 2021 Tombouctou
Theme by Anders Noren — Up ↑
















コメントを残す