はじめに
過去二十年間は、弁病変の病因の成長範囲がスペインの大動脈弁逆流(AR)1バルブは、弁機能における大動脈根(AoR)の役割の我々の改善された知識のおかげで説明することができるARと上行大動脈(AA)のリーフレットと付随する拡張の比較的小さな病変を提示します。,2aorの部品の幾何学的な関係そして動的挙動はリーフレットに構造損傷がないとき弁の能力を保障するために見られました。3Valsalva(SV)、sinotubular接続点(STJ)、および交連の副鼻腔は非常に特殊化された構造である:本物の”supravalvular”大動脈装置。4,5その結果、長い期間にわたって進化したAA動脈瘤では、リーフレットの挿入を歪める幾何学的変化が起こると、これらの開閉が変更され、それらが無,6これに対応して、弁温存手術(VSS)技術は、大動脈瘤手術で開発されています。 さらに、AR修復への関心は、現在補綴物による弁置換の代替として提供されている時点まで高まっています。7,8これまで、ARにおけるVSSおよび/または弁修復に関する決定は、手術室の外科医によって見つかった解剖学的病変に基づいており、患者は誘発心停止および大動脈は空である。, しかし,術中経食道心エコー検査の開発は,開胸前の大動脈根および弁のリアルタイムビューを提供する。9私たちの目的は、経食道心エコー検査(TEE)を用いてAR機能解剖学のin vivo解析を行うことです。 私たちは、基礎となる病変とメカニズムを記述し、直接外科検査と比較してTEEの診断精度を研究し、大動脈VSSの最適候補を同定する上でその価値を確,
方法
研究集団
私たちは、大動脈弁疾患および/またはAA拡張と診断された335人の連続した患者を2002年から2005年の間に当センターで手術しました。 本研究では、以下の基準を満たした66人が含まれています:a)単離されたグレード≥2ARとb)重度のARまたは近位大動脈寸法を理由に手術の適応;c)大動脈切開術および病変の直接、独立した外科的検査を用いた外科的探査;およびd)慣習的な術前または術中経食道心エコー検査の利用可能性。, ARの緊急手術を受けている患者または急性大動脈症候群を呈している患者を除外した。 年齢,左心室機能不全,慢性AR原因,僧帽弁または冠動脈手術の併用を理由に患者を除外しなかった。
大動脈逆流の外科的解剖学
解剖学的病変は、直接および肉眼的検査のために以前に確立された基準に従って診断された。,病変およびメカニズムの10の記述は、外科的検査を行う際に外科医が提供する個人的な通信に基づいて、外科医の報告または著者(PGG)のいずれかから、変
AoRの体系的な検査は、すべての症例で行われました。, 外科医のレポートは、AA拡張の解剖学的形態、カスプの数、小葉病変(石灰化、交連融合およびリウマチ性疾患を示す肥厚、直系開窓および交連の自由境界の肥厚、植生または穿孔、構造的病変および脱出の欠如)、フラップまたは解剖および大動脈壁破裂に関するデータを提供した。, a)機能的,有機病変または脱出がないが、機能的な大動脈輪(STJおよび/または環)拡張が存在する場合,AAまたはAoR動脈瘤を有する患者のように;b)非常に広範な巨視的構造病変を有する制限リーフレット運動;c)穿孔;およびd)脱出,各リーフレットの自由境界長の違いによって定義されます,これらのうちの1または2は、残りの部分を超えます., 脱出は絶対(リーフレットの自由なボーダーはSVの壁の挿入の下にある)および相対的(リーフレットの自由なボーダーはSVの壁の挿入と同じレベルにしかし残りのリーフレットの自由なボーダーのレベルの下にある)として亜分類される。
外科医は心エコー検査研究が行われていることを知っていたが、進行中の比較研究に気づいていなかった。 大動脈VSSを試みる決定は、心エコー検査所見ではなく外科的所見に基づいていた。, 残りの症例,または機能的手術が失敗した場合には,大動脈弁置換術(aaを冠上管と組み合わせた置換の有無にかかわらず)またはBentall法を用いた弁導管によるAA置換を外科医の基準で用いた。
経食道心エコー図
すべての患者は、術前または術中のカラードプラーTEEを受けました。, 経食道心エコー検査は、acuson Siemens-Sequoia C-256(マウンテンビュー、カリフォルニア州、米国)、Image Point HX(フィリップス、アンドーバー、マサチューセッツ州、米国)またはEnVisor C(フィリップス、アンドーバー、マサチューセッツ州、米国)5-7MHz経食道マルチプレーンプローブを使用していた。 動画画像および静止画像をDICOM形式で保存した。 すべての研究は、磁気光学ディスク上およびデジタル形式で記録された。 報告は、患者が心irc環停止に入る前に著者の2人によって行われた。 各パラメータを3回測定し、平均を統計分析に使用しました。,
我々は、120º-145°に角度を回転させ、大動脈弁の標準的な短軸中部食道投影画像とAAと大動脈弁の長軸中部食道投影画像を得た。 両症例とも,尖部における器質病変の数と不在または存在を分析した。 大動脈脱は収縮期に正常に現れたときにしなやかまたは冗長な自由境界弁小葉の存在下で起こったが,拡張期には心室流出路に完全な小葉外転または拡張期突起を示したと考えられた。, 我々は、アニュラス、SV、STJ、およびAAの寸法とSTJ係数のようなそれらの間の幾何学的関係を測定しました:アニュラス(normal、
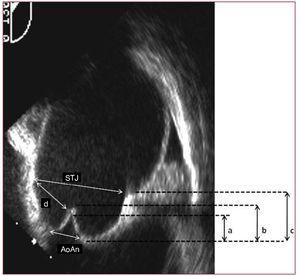
図1。 大動脈根の中部食道長軸投影画像我々は、環と洞管関節(STJ)の寸法とそれらの間の幾何学的関係を同定する:STJ:環、環-STJ距離関係またはValsalvaの洞の高さ(c)、各リーフレットの有効高さ(b)およびテンティングの高さ(a)。 (AoAnは大動脈輪を示します。,)
統計分析
量的変数は平均(SD)として表され、カテゴリ変数は頻度のパーセンテージとして表される。 量的変数については、正規分布についてはANOVAを使用し、非正規分布についてはKruskal-Wallisを使用してグループを比較しました。, 外科的検査を基準として,aorおよびAAのカスプまたは幾何学的distortionみに基づくメカニズムおよび病変を診断するために,感度,特異性,陽性および陰性予測値およびteeの精度または一般的な診断精度を決定した。 診断値は、95%信頼区間(CI)およびそれに対応するκ値を持つパーセンテージとして表されます。
Cohen kappa係数を使用して、修復または弁置換に関するTEEベースの決定と外科的検査に基づく決定との間の一致のレベルを決定した。,
我々は遡及的に心エコーメカニズム、ジェット方向と幾何学的関係(図1)と大動脈VSS技術とAA置換手順の成功との関係を分析しました。, 多変量解析は、p
結果
大動脈拡張は、変性弁疾患に関連しているかどうかにかかわらず、大動脈条件(53%)のための私たちの地理的領域のリファレンスセンターで手術のために示された患者における孤立したARの主な原因である。, AAのarteri化性動脈瘤を有する患者の40%および環状大動脈拡張症を有する7/16患者まで、大動脈瘤に関連する小葉の線維弾性変性を見出した。 それほど頻繁ではない原因は、先天性大動脈弁疾患(21.2%)、感染性心内膜炎(4%)、およびリウマチ性疾患(4.5%)などの弁病変であった。 わずか2人の患者では病因が不明であると考えられていた(3%)。
外科的所見
外科的検査は、我々は非弁膜原因ARのラベルの下に一緒にグループ化された35人の患者を特徴付けるために私たちを有効にしました。, これは、小葉の明らかな巨視的構造病変および/または>2.1cm/m2SVまたはAAのレベルで大動脈の直径の拡張を伴うARによって特徴付けられた。
大動脈拡張の3つの解剖学的形態について説明した:AA動脈瘤(タイプ1)、大動脈の拡張がSTJの遠位に起こり、SV形状が保存されている場合(9人の患者)、大動脈根の動脈瘤(タイプ2)、副鼻腔の拡張がAAの拡張の有無にかかわらず起こるが、大動脈輪は25mm(18人の患者)である。, 非弁膜ARを有する2人の患者のみでは、AAおよびAoRは正常であり、環およびSTJの拡張は唯一の幾何学的distみとしてであった。
私たちのシリーズでは、2つの非弁状原因ARメカニズムが手術で発見されました(図2):STJの拡張(14患者;41.2%)と弁脱(19患者;55.9%)による肉眼的に正常なリーフレット 後者は、外科医によって6/19で絶対として分類され、13/19患者では相対として分類された。, 基礎となるメカニズムは、2例(2.9%)のみで自由境界線の直線開窓であり、1(
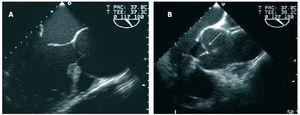
図2で小葉の比較的少ない石灰化であると考えられていた。 大動脈の長軸投影心エコー画像は、大動脈逆流を引き起こす非弁膜の基本的なメカニズムを示す。 A:機能的には、sinotubular関節の拡張が交連を外側に変位させ、小葉の動きを制限し、拡張期における中心におけるそれらの凝固を回避する。, B:相対脱および大動脈根動脈瘤。
経食道心エコー検査の診断値
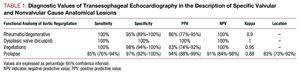
表1は、すべての66人の患者における特定の病変を分類する際のTEEの診断値をまとめたものである。 病因を分類し(87%;95%CI、78-95;kappa=0.82)、大動脈拡張の解剖学的形態を特徴付ける(>88%;95%CI、80-96;kappa=0.83)ためのTEEの一般的な診断精度は優れている。, しかしながら、リーフレットの解剖学的病変の詳細な説明では、良好であるが、診断精度は最適ではない(83%;95%CI、73-92;Kappa=0.778)。 ARメカニズムの説明は、グループ間の適切なレベルの一致(Kappa=0.8)を達成し、診断精度の点では85%(95%CI、77-94)を意味します。 弁脱は、TEE(23/27)によるARの解剖学的および機能的評価における原理不一致であった。 他の診断偽陰性は、変性状態(7/9)で提示する自由境界の開窓であった。, 両症例とも,逆流のメカニズムの偽心エコー診断はAA拡張による弁小葉のテザリングであった。
経食道心エコー検査による修復可能性の予測
我々は32/66患者と34/66上の弁置換に大動脈VSSを行いました。 術中TEE予測された大動脈VSSは、症例の割合が高い(90%)の初期手術として、弁修復技術に関連しているかどうかにかかわらず、適用可能であった。 また、80%の手順の成功を予測しました。, 同様に、teeは、最初の外科的検査がVSS(25/34)を試みることを明確に除外したほとんどの場合、弁置換を正しく予測した。
大動脈VSSの適用性に有意に関連する病変の解剖学的および機能的分類におけるTEEの使用(PPP=.03).
私たちのシリーズでは、メカニズムをdescriedするTEEの使用は、aor修復可能性の予測を最も容易にするパラメータでした(p
非弁状ARにおける、逆流ジェットのメカニズムと方向(中央、71%の成功対29%の失敗;P=。,001)、有効リーフレットの高さの違いの対称性または欠如(成功b、0、対失敗、2.8の違い;P=。005)は、リーフレット修復なしのリモデリング手術の成功の可能性と独立して関連する変数であった(表2)。

最後に、我々は動脈瘤の異なる解剖学的臨床形態とAA置換手順(P=。,004):タイプ1、冠上導管、弁プロテーゼの有無にかかわらず(13/19);タイプ2(3/5)の根の改造、またはタイプ3またはマルファン症候群のBentallのプロシージャを使用した弁付き導管内のネイティブ弁の再移植(19/24)(図3)。
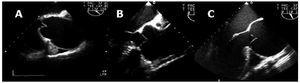
図3. 経食道心エコー検査上行動大動脈拡張の異なる解剖学的-臨床的形態の画像A:管上拡張。, B:大動脈根拡張。 C:環状大動脈拡張症。
議論
AA条件に関連する非弁膜形態が最も頻繁な原因となっているため、ARの外科的管理が変更されました。1これらの技術の成功は、根および大動脈弁の機能的解剖学に依存し、術前病変診断の重要性を強調している。, 僧帽弁不全のように,TEEは弁および非弁の原因ARの基礎となるメカニズムおよび解剖学的病変の術前評価および特に大動脈VSS技術の候補の最適な選択において大きな価値があることを示した。
解剖学的病変の診断
arの特定の形態ごとに術前TEEの診断値を分析すると、AA動脈瘤および弁膜原因病変の記述の感度および特異性(>95%), さらに,両尖弁の全症例はTEEによって正しく診断された。 これは、Alegretらによって最近公開されたデータと一致する。11しかし、我々はnonvalvular ARで矛盾を発見しました。 主に,これらは相対脱出および自由境界開窓の診断において起こった。 これらの症例では,弁病変は正常小葉および機能障害と誤って診断された。
根動脈瘤では、SV拡張はリーフレット組織リモデリングを引き起こす可能性があります。, この改造は大動脈が幾何学を失い、自由なボーダー延長および厚化が起こるときリーフレットの機械積み過ぎを補う試みです。12したがって、相対的な脱出はこれらの患者の共通の損害です。 大動脈充填の明らかに異なる条件下で外科的および心エコー検査を受けた多くの人では、非常に微妙な伸張によって引き起こされるリーフレット病変はTEEで見過ごされることがあり、AA拡張は誤って唯一の病変と診断されることがある。, 当シリーズは、両方のメカニズムtentingの高さが上昇し、対称性の効果的なリーフレットの高さで判別します。
大動脈VSSの文脈において脱出を同定することが不可欠である。 既存の脱出を訂正しないことは繰り返し弁の注入または根の改造のprocedures13の早い失敗の第一次原因であり、修理された弁の有効で低いcoaptationの高さは逆流に進み、繰り返しの介在を要求するそれらを識別する。,14最近、私たちのようなARシリーズでは、Le Polain de Waroux et al15およびEl Khoury et al16は、心エコー検査の原理診断エラーを構成する病変タイプを記載しています。 それらは、偏心した方向を有する逆流ジェットによって特徴付けられる。 このシリーズでは、中心ジェット方向は大動脈VSS成功と関連しています。, したがって、非弁膜ARにおける偏心ジェットの存在は、まだ見かけの構造的なリーフレット病変が存在しない場合、外科医は慎重に解剖学的構造と見過ごされるかもしれない脱出または開窓を診断するためにリーフレットの自由境界の長さを探索することを余儀なくされる。
メカニズムの診断
弁膜疾患における心エコー検査の原則の貢献の一つは、血圧を伴う生理学的条件で機能する弁およびAoRの詳細な画像を得ることを容易にすることである。, ARでは,十分な患者選択のための全会一致で受け入れられた基準はまだ存在しない。 VSSおよび/または弁修復に関する決定は、劇場で外科医によって見つけられた解剖学的病変に基づいて行われ、心臓は停止し、大動脈は空である。 しかし、我々は、in vivo動脈圧が(変性状態で起こるように)弾性に変化を伴う小葉または大動脈の挙動に及ぼす影響を無視することはできません。, 術中TEEの開発により,開胸前の逆流のメカニズムに対する構造的-機能的相関に系統的な近似を行うことができた。 これらの結果は,AR機構の心エコー診断とこれらの外科的手技の成功との間に有意な関係を示した。 リーフレットテザリングによるSTJ拡張による機能的AR患者は大動脈VSSに対する最良の候補である。, したがって、Le Polainら15が示すように、大動脈修復において、メカニズムを診断する際のTEEの役割は、AA動脈瘤の外科的治療において大動脈VSSを正常に適用する確率を決定する際に外科医にとって重要であり得る。
修復可能性の診断
大動脈瘤手術では、大動脈VSSの成功の高い確率は、aorta17および重度のARの極端な寸法が結果を制限する前に、技術の早期適用,18少数の患者がVSS技術を受けているという事実にもかかわらず、私たちの患者における病変の解剖学的および機能的分類は、大動脈VSSの適用性に大
リーフレットのティッシュの質はreparabilityを保証する主義の要因です。19さらに、広範な小葉病変がない場合、逆流ジェットの方向は、心エコー図シリーズ15および外科的分類の両方において、機能的ARと弁状ARを区別する原,16,20しかし、ベルギーの心エコーおよび外科シリーズ15、16およびフランスの機能分類20は、ジェット方向の重要性について意見が一致しない。 Lansacら20は、これが機能的な環拡張によるものであるとき、中央ジェットがARの特徴であると考えている。 提案したSVに関するリーフレットの幾何学的関係パラメータにより,これらの発散所見を説明することができた。, リーフレットの異なる有効高さのみが多変量解析において統計的有意性を達成した。 したがって、小葉の構造的病変がない場合に偏心ジェットに直面し、teeは弁小葉の拡張期テンティングの可能性を示すかもしれないが、21我々はそうでなければ見過ごされるかもしれない脱出を診断するためにそれらの対称性を確認する必要がある。
大動脈瘤を治療するために、様々な大動脈VSS技術が開発されている(リモデリングおよび再移植)。 彼らの目的は、病変を修正し、AoRダイナミクスを維持するARを修復することです。,22本研究では、AA拡張の異なる解剖学的臨床形態の心エコー検査記述と大動脈置換手順の選択との間に密接な関係が存在することを示している。 しかし、マルファン症候群23または解剖の家族歴を有する患者は、動脈瘤の形態にかかわらず、弁再移植を受けた。 したがって、ある手技または別の手技の選択は、外科医の経験とともに、基礎疾患および動脈瘤の解剖学的形態に依存する。,
結論
術中TEEは、すべての形態のARにおいて、弁およびAoR病変および弁不全のメカニズムの正確な記述を可能にする。 それは一般に外科的観察と一致し,大動脈VSS技術およびAA置換手順の適用性を適切に予測する。 構造的病変のない小葉を有する大動脈の動脈りゅうに続発する非弁膜機能ARは,小葉修復の有無にかかわらず大動脈弁温存術の最良の候補である。,
略語
AA:上行大動脈
AoR:大動脈根
AR:大動脈逆流
STJ:洞管接合部
SV:バルサルバ洞
TEE:経食道心エコー図
VSS:弁温存手術
513-5ページの社説を参照
















コメントを残す