はじめに
真核細胞の核における複製は、三つのDNAポリメラーゼを用いる:ポリメラーゼα、δ、およびγ(Hubscher et al.,2002;Pavlov et al.,2006b;Kunkel and Burgers,2008;Loeb and Monnat,2008;Burgers,2009;Pavlov and Shcherbakova,2010;Lange et al., 2011)., DNA合成は方向性があり、5’から3’に進み、プライマーの3’OHによるヌクレオチドのαリン酸に対する求核攻撃は、ヌクレオシド一リン酸の取り込みとピロリン酸の放出をもたらす(Steitz、1999)。 すべてのDNAポリメラーゼはDNA合成を行うためにプライマーと遊離の3’OHを必要とし、pol αも例外ではない。 Polαは二つのプライマーゼサブユニットと二つのポリメラーゼサブユニットからなるヘテロテトラマーである。, プリマーゼサブユニットは、短い(7-12個のリボヌクレオチド)RNAプライマーを合成することによってDNA複製を開始し、その後ポリメラーゼαによって拡張される(Pellegrini、2012)。 DNAポリメラーゼδおよびγは、pol αによって生成されたプライマーを正確かつ順行的に伸長させる(Kunkel、2004、2011;Pellegrini、2012)。 酵母では、DNAポリメラーゼδは遅延鎖のDNA合成に必須であることが示されているが、polβは主に先行鎖で機能するように見える(Pursell et al.,2007;Nick Mcelhinny et al.,2008;Kunkel,2011;Georgescu et al., 2014)., これに対して、ミトコンドリアにおいては、複製は唯一のポリメラーゼ、DNAポリメラーゼγの責任である(Lee et al., 2009).
DNAポリメラーゼは、七つのファミリー(A、B、C、D、X、Y、およびRT)にグループ化されています。 真核生物では、三つの核複製DNAポリメラーゼは、Bファミリーに属することが起こる(Burgers et al.,2001;Patel and Loeb,2001). 酵母からの三つの複製DNAポリメラーゼすべての結晶構造が存在し、それらの共有構造要素の比較とそれらのユニークな特徴の研究を初めて可能にする(Swan et al.,2009;Perera et al.,,2013;Hogg et al.,2014;Jain et al.,2014a)。 すべての三つの複製DNAポリメラーゼは、マルチサブユニット酵素である(表1)(Johansson and Macneill,2010;Pavlov and Shcherbakova,2010;Makarova et al., 2014). このレビューの主な焦点は、それらの触媒ドメイン、またはサブユニットAにあります。
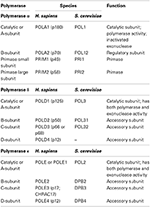
表1。 真核生物のDNAポリメラーゼは、マルチサブユニット酵素である。,
Bファミリーポリメラーゼの全体的な構造
すべてのDNAポリメラーゼは、指、手のひら、親指の三つのサブドメインからなるヒトの右手と比較されている共通のポリメラーゼ折り目を共有する(Steitz,1999;Patel and Loeb,2001)。 四つの反平行β鎖と二つのヘリックスからなる高度に保存された折り畳みである手のひらは,モチーフA,DXXLYPSおよびモチーフC,DTDに位置する二つの厳密に保存された触媒アスパラギン酸塩を保有している(Delarue et al.,1990;Braithwaite and Ito,1993)。, このRRM様フォールドは、DNAおよびRNAポリメラーゼ、逆転写酵素、CRISPRポリメラーゼ、さらには逆(3′-5′)トランスフェラーゼ、例えばThg1(Anantharaman et al.,2010;Hyde et al., 2010). 対照的に、thumbおよびfingersサブドメインは、実質的により多くの構造的多様性を示す(Steitz、1999)。 指は結合DNAおよび正しい入って来るヌクレオチドに立体配座の変更を経ます。 この動きにより、指サブドメイン内の残基が新生塩基対のヌクレオチドと接触することが可能になる。, 親指は複製中にDNA二重鎖を保持し、その過程に関与する(Doublié and Ellenberger,1998;Doublié et al., 1999).真核生物DNAポリメラーゼα、δ、およびγは、多くの古細菌、細菌、バクテリオファージおよびウイルスポリメラーゼと相同性を共有する(Delarue et al.,1990;Braithwaite and Ito,1993;Franklin et al.,2001;Firbank et al.,2008;Wang and Yang,2009)。, Kooninと共同研究者は、古細菌DNAポリメラーゼの詳細な系統発生解析と真核生物ポリメラーゼとの関係を、ポリメラーゼMakarova et alに捧げられた微生物学におけるフロンティアのこの問題に貢献した。 (2014).すべてのBファミリーポリメラーゼは、酵素のコアを構成する指、親指、および手のひら(上記)、ならびにエキソヌクレアーゼドメインおよびN末端ドメイン(NTD)(Franklin et al.,2001;Xia and Konigsberg,2014)(図1;表S1)。, エキソヌクレアーゼドメインは3′-5’の校正活性を持ち、誤ったヌクレオチドを除去する。 エキソヌクレアーゼ活性部位はポリメラーゼ活性部位から40-45Å離れた位置にある。 NTDは触媒活性を欠いているようである。 Polδにおいて、NTDは、OBフォールドに似たトポロジーを有するものと、一本鎖DNA結合モチーフを有するものと、RNA結合モチーフ(RNA認識モチーフまたはRRM)を有するものとの三つのモチーフからなる(Swan et al., 2009). バクテリオファージT4では、NTDの変異はポリメラーゼの発現を減少させる(Hughes et al., 1987)., RB69およびT4では、gp43ポリメラーゼはおそらくNTDを介してそれ自身のメッセンジャー RNAに結合し、翻訳を抑制する(Petrov et al.,2002)、これはpol δには当てはまらないようである(Swan et al., 2009). 新しいデータは、NTDが他のドメインとの相互作用を通じてポリメラーゼの安定性および忠実度に役割を果たすことを示す(Li et al.,2010;Prindle et al.,2013)(下記参照)。
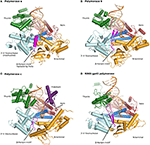
図1. ポリメラーゼα、δ、γ、およびRB69gp43の三元錯体は、比較のために同一の向きから図示されている。, 親指(緑)および指(濃い青)ドメインは、二本鎖核酸(ベージュで示されるプライマー、オレンジで示されるテンプレート)を掌ドメイン(赤)に対して把握する。 N末端ドメインは金で、3′-5’エキソヌクレアーゼドメイン(シアン)に隣接して現れる。 (A)ポリメラーゼα(PDBID4FYD)はRNA/DNAハイブリッドに結合し、a型DNAの広く浅い小溝が親指の近くで明らかである。 3′-5’エキソヌクレアーゼドメインは活性を欠いている。 不活性化されたエキソヌクレアーゼドメインのヘリカル領域(マゼンタ)は、テンプレートの5’endを安定化させる。, (B)ポリメラーゼδ(PDBID3IAY)は、校正の際にポリメラーゼ活性部位からエキソヌクレアーゼ活性部位にプライマー鎖を切り替えるのに重要である大きなβヘアピンモチーフ(マゼンタ)を保有する。 (C)ポリメラーゼγ(PDBID4M8O)は、増加した処理性とポリメラーゼを付与するユニークなPドメイン(紫)を振るう。 興味深いことに、βヘアピンモチーフはpolβで萎縮している。, (D)家族B DNAポリメラーゼフォールド、およびドメイン組織の保存は、バクテリオファージRB69gp43(PDBID2OZS)からのモデル酵素が三つの真核生物複製ポリメラーゼと共に見られるときに明らかである。 各ポリメラーゼのドメイン描写は表S1に示されている。 図はPyMOL(PyMOL Molecular Graphics System、バージョン1.5.0.4Schrödinger、LLC。).
すべての哺乳類のBファミリー DNAポリメラーゼは、c末端ドメイン(CTD)に二つのシステインに富む金属結合部位(CysAおよびCysB)を保有することが知られている(図2)。, Cysaは亜鉛結合部位であるが、Cysbは鉄硫黄クラスターであると推定される(Netz et al., 2012). 酵母pol δのCTDにおけるクラスターの損失は、そのアクセサリーb-サブユニットとの相互作用に負の影響を与える(Sanchez Garcia et al., 2004). 亜鉛結合モチーフは、pol δとその処理性因子であるPCNAとの相互作用に重要であることが示された(Netz et al., 2012).

図2. 三つのSaccharomyces cerevisiae複製DNAポリメラーゼα、δ、およびγの概略図。, 比較のためにバクテリオファージRB69からのDNAポリメラーゼを示した。
DNAポリメラーゼα
DNAポリメラーゼαの触媒サブユニットは、1468個のアミノ酸から構成されている(表2)。 結晶化のために設計されたタンパク質構築物は、N末端およびC末端(残基349-1258)で切断されたため、CTDおよびそのクラスターを欠いている(図2)。 構築物は、非結晶化され、DNA/RNAハイブリッドオリゴヌクレオチドとの二元複合体、およびDNA/RNAおよび入ってくるヌクレオチドとの三元複合体(Perera et al.,2013)(図1)。,

テーブル2. 既知の構造のBファミリーのDNAポリメラーゼのコンパイル。
ポリメラーゼの離脱のメカニズム
結晶中に捕捉されたRNA/DNAオリゴヌクレオチドは、予想通りA型の立体配座を採用する。 Thumbドメインは、疎水性contactsおよび極性相互作用の両方を介して、RNAプライマーと複数の相互作用に関与する(Perera et al., 2013)., 溶液中での実験により、POL αによるRNAプライマーの伸長は10-12ヌクレオチドに制限され、これはヘリックスの一ターンに達することが示されている。 この観察により、pol αによるプライマー合成の終了機構が示唆され、thumbとRNAの間の特異的相互作用が失われると、ポリメラーゼがDNA/RNAオリゴヌクレオチドから離脱し、複製ポリメラーゼに手を差し伸べることができることが示唆された。,
手のひらドメイン内の動きは、pol αの転座を促進することができる
三つの状態(apo、二元、および三元)で酵素を結晶化した著者は、すべての三つの構造モデルをオーバーレイすることができました。 Polαは三つの状態がすべて結晶構造で捕捉された唯一の真核生物ファミリーB DNAポリメラーゼである。 構造的重ね合わせにより,基質結合およびヌクレオチジル移動に伴う指および親指サブドメインの十分に文書化された動きに加えて,手のひらサブドメイン自体が構造的再配列を受けることが明らかになった(Perera et al.,, 2013). 著者らは、パームドメインの異なる立体配座が、RNA/DNA二重鎖に沿っておよびそれを超えてpol αの転座を促進することができると提案している。 上記のように、RNA鎖への接触の喪失は、プライマーの放出を引き起こすと予測され、次いで、プライマーは、polδ又はγによって伸長のために利用可能になる。,
不活性化エキソヌクレアーゼサブドメインにおける異なるタンパク質フォールド
校正活性は、すべてのカルボキシレートの変異により、pol αで廃止される(Asp114/Glu116/Asp222/Asp327RB69gp43のSer542/Gln544/Tyr644/Asn757の構造ベースのアライメントに対応する)(表2)。 さらに、Bファミリーのほとんどのポリメラーゼ(残基246-267rb69gp43)に見られるβ-ヘアピンモチーフは、pol α(残基667-676;681-693)の螺旋領域に置き換えられる(Hogg et al., 2007)., Βヘアピンはエキソヌクレアーゼドメインの一部であり、T4およびRB69polsにおいて、ポリメラーゼとエキソヌクレアーゼ活性部位との間のDNAプライマーの分配に関与することが示されている(Reha-Krantz,1988;Stocki et al.,1995;Hogg et al., 2007). 校正活性がない場合、このモチーフがpol αに保持されなかったことは驚くべきことではない。 チミンおよびグアニン塩基を有するpol αスタック中のヘリカル領域の残基His684およびPhe685は、それぞれ、テンプレートの不対5’endの位置-3および-2にある(Perera et al., 2013)., したがって、pol αでは、β-ヘアピンモチーフに対応する領域は、異なる折り畳み(ヘリックス対β鎖)および異なる機能(活性部位の切り替えを促進するのではなく、テンプレート鎖の不対領域を安定化する)を採用する。 Pol αは校正活性を欠いているので、短いオリゴヌクレオチドが修正されるかどうか、もしそうであればどのDNAポリメラーゼによって修正されるかという疑問が生じる。 Pol αによって合成されたプライマーの校正は、pol δによって行われるようである(Pavlov et al.、2006年)。,
DNAポリメラーゼδ
ヒトpol δは四つのサブユニットから構成されているのに対し、Saccharomyces cerevisiaeは三つのサブユニットから構成されている(Gerik et al.,1998;Liu et al.,2000)(表1). DNA複製におけるその機能に加えて、pol δはDNA修復および組換えにおいて役割を果たすことが示されている(Hubscher et al.,2002;Lee et al.,2012;Tahirov,2012). ヒトpol δにおける最小のサブユニットであるP12、および出芽酵母には見られないサブユニットも、DNA損傷に応答して分解される(Lee et al., 2014). 酵母pol δ(POL3)の触媒サブユニットは1097残基から構成されている。, 結晶化のために使用される構築物は残基67-985を含み、したがってCTDを欠く(図1;表2)。
ポリメラーゼ活性部位における第三の金属イオン
パームドメインは、三つの保存されたカルボキシレート(Asp608、Asp762、およびAsp764)が含まれています。 二つの触媒アスパラギン酸、Asp608とAsp764は、3.7Åで分離されたポリメラーゼ活性部位に二つの金属イオン(Ca2+)に接触する。 興味深いことに、入ってくるヌクレオチドのγリン酸とGlu802によって配位された第三の金属が観察され、Glu800が近くにあった。, 両方のグルタミン酸塩をアラニンに変異させると、正しいヌクレオチドと誤ったヌクレオチドの両方に対して取り込み効率が低下したポリメラーゼ変異体, 2009). これらのアミノ酸位置において、pol αおよびpolβはまた、カルボキシレート残基を有する(pol δ Glu800/Glu802は、pol α Asp1033/Asp1035およびpolβ Glu945/Asp947に対応する)。 かどうかのカルボン酸の遊び同様の役割を果pol αおよびεは要であることを説明しました。,
高忠実度および校正
ヒトpol δは、1あたり22,000の誤差周波数を有するヌクレオチジル移動反応を触媒する高忠実度ポリメラーゼである(Schmitt et al., 2009). 校正は、ポリメラーゼの忠実度を10-100倍に向上させる(Mcculloch and Kunkel,2008;Prindle et al., 2013). Pol δは、約45Åで分離されたポリメラーゼおよびエキソヌクレアーゼ活性部位を有する(Swan et al., 2009). 校正活性を持つDNAポリメラーゼは、挿入部位を越えて塩基対のマイナーな溝を接触させることによって、誤って組み込まれたヌクレオチドを感知することができる。, このタンパク質は、それぞれプリンおよびピリミジンのN3およびO2位置で普遍的な水素結合受容体と相互作用する(Seeman et al.,1976;Doublié et al.,1998;Franklin et al., 2001). これらの水素結合の接触は、塩基対がWatson-Crick幾何学を採用し、不一致の場合に失われたときに保存される。 RB69gp43において、接触は、新生の塩基対を超えて最初の二つの塩基対まで伸びる(Franklin et al.,2001;Hogg et al., 2004, 2005). 接触は、pol δにおいてはるかに広範であり、挿入後の五塩基対にまで及ぶ(Swan et al.,、2009)、その高忠実度に貢献することができます。
上述したように、エキソヌクレアーゼドメインからのβ-ヘアピンセグメントは、T4およびRB69polsにおける重合および校正部位間のDNAの分割において重要な役割を果たす(Stocki et al.,1995;Hogg et al., 2007). RB69gp43では、β-ヘアピンモチーフは、複合体が損傷していないDNAで得られたかどうかに応じて、異なる立体配座を採用する(Franklin et al.,2001;Zahn et al.,2007)または損傷を含むDNA(Freisinger et al.,2004;Hogg et al., 2004)., チミングリコールとの複合体中のプライマー鎖および鋳型鎖の両方を接触させることを完全に可視化した(Aller et al., 2011). 同様に、pol δ中のβヘアピンはDNAの主溝に突出し、二本鎖DNAと鋳型鎖の一本鎖5’端との間のくさびとして作用し、これは二つの芳香族残基Phe441およびTyr446によって安定化される(図1)(Swan et al., 2009). Βヘアピンの位置は活性部位スイッチングにおける役割と一致した。,
ドメイン間Contactsおよび忠実度
癌に関与する変異は、主にpol δおよびγのエキソヌクレアーゼドメインに見出され、突然変異の発生率を低下させる,2013;Henninger and Pursell,2014). ヒト結腸直腸癌における一つの変異は、指ドメイン、R689Wに局在し、酵母における類似の変異(R696W)は、突然変異原表現型をもたらす(Daee et al., 2010)., 酵母pol δ(A699Q)の指サブドメインの高度に保存されたモチーフBにおけるArg696の近傍の変異も突然変異原表現型をもたらす。 指のこの領域はNTDのすぐ近くにあります。 NTDのMet540をアラニンに変異させると、a699qの変異原表現型が廃止され、指とNTDとの間の相互作用がポリメラーゼの忠実度に影響を与え得ることが示される(Prindle et al., 2013)., T4およびRB69polsにおいても同様に、N末端およびpalmドメインからの残基を含むNPLコアモチーフは、fingersドメインと接触しており、ポリメラーゼ-DNA複合体を安定化することが示されている(Li et al., 2010).
DNAポリメラーゼγ
DNAポリメラーゼγの触媒サブユニットは、非常に大きな遺伝子(酵母では2222アミノ酸、ヒトでは2286アミノ酸)の産物であり、ポリメラーゼγ(Bファミリーのメンバー)およびpolβ、ファミリー Aポリメラーゼ(それぞれ3130アミノ酸および2590アミノ酸)に次ぐ大きさである(Lange et al.,,2011;Hogg and Johansson,2012)(図1;表2). Polβはpolδの倍の大きさであり,二つのタンデムポリメラーゼ/エキソヌクレアーゼ領域から構成されている。 N末端セグメントはポリメラーゼと校正活性の両方を有し,C末端セグメントは不活性化される。 二つのエキソヌクレアーゼ-ポリメラーゼモジュールは遠くに関連している(Tahirov et al., 2009). 不活性化されたセグメントは複製中に構造的役割を果たすと推定されるが、二つのグループは、c末端モジュール全体を欠いている触媒的に活性なpolβ構築物(残基1-1228;1-1187)を結晶化することができた(Hogg et al.,,2014;Jain et al.,2014a)。 両結晶構造はポリメラーゼ,DNAプライマー/テンプレートおよび入ってくるヌクレオチドの三元複合体であった。
Palmドメインから発せられる新規な処理性ドメイン
Polβは、高い処理性のためにDNAスライディングクランプPCNAを必要としない点でpol δとは異なる(Hogg and Johansson、2012)。 Polβのパームドメインは、pol αまたはδのそれよりも実質的に大きい(380残基)(それぞれ175残基および203残基)。, 最近のpolβ結晶構造は、palmドメインの挿入が三つのβ鎖と二つのヘリックスからなる新しいドメインを集合的に形成することを明らかにした(残基533-555;682-760)(Hogg et al.,2014;Jain et al.,2014a)(図1;表S1)。 残基690-751を削除すると、減少したポリメラーゼ活性を有する変異体をもたらした。 さらに、リン酸骨格の近くに位置する正に荷電した残基(His748、Arg749、およびLys751)を変異させることは、酵素の処理性に影響を与えた(Hogg et al。, 2014)., 手のひらに由来する余分なドメインは、その機能にちなんでprocessivityまたはPドメインと名付けられました。 Pドメインの塩基は、金属結合部位を有する(下記参照)(Hogg et al.,2014;Jain et al.,2014a,b).
ポリメラーゼドメイン内の鉄硫黄クラスター
意外にも溶液研究により、酵母ポリメラーゼγ自体の触媒サブユニットがそのポリメラーゼフォールド内にクラスターを含んでいることが明らかになった(Jain et al.,2014b)、CTD内のクラスタに加えて(図2;表2)。, Polβ内の第二のクラスターは、このポリメラーゼが酸化ストレスに対してより敏感であることを示唆している(Jain et al.,2014b)。 しかし、polβの結晶構造は、ポリメラーゼドメイン内のクラスターを明らかにしなかった(Hogg et al.,2014;Jain et al.,2014a;Zahn and Doublié,2014)。 二つのシステイン残基は構造モデルにおいて無秩序であり、得られた金属結合部位は亜鉛に結合するように見える(Hogg et al.,2014;Jain et al.,2014a)。 金属結合タンパク質における非天然亜鉛によるaの置換は珍しいことではない(Netz et al.,2012)クラスターが不安定であるとして。, Polβのポリメラーゼドメイン内を可視化することは嫌気性条件を必要とする可能性がある。
エキソヌクレアーゼドメインの短いβ-ヘアピンモチーフ
ポリメラーゼとエキソヌクレアーゼの両方の活性を有する任意のDNAポリメラーゼにおいて、結合したDNAは二つの活性中心の間で平衡にある(Beechem et al., 1998). 入ってくるヌクレオチドの濃度と損傷塩基またはミスペアの存在は、ポリメラーゼ活性部位から校正活性部位へのDNAの移動に影響を与える二つの要, ポリメラーゼは、新たに形成された塩基対のマイナー溝側を監視し、不一致をチェックする方法として、普遍的なH結合受容体、O3、およびN2と相互作用する(Seeman et al.,1976;Franklin et al., 2001). Polβのユニークな特徴は、エキソヌクレアーゼドメインTyr431からの残基を介して初期塩基対の主要な溝側への接触である。 さらなる分析は、polβの高忠実度におけるこのチロシンの潜在的な役割を解明するために保証される。,polδにおいて、β-ヘアピンセグメントは、それ自身をDNAに挿入し、一本鎖DNAと二本鎖DNAの間のくさびとして作用する(Swan et al., 2009). 大腸菌DNA pol IIにおいて、βバレルの挿入は、重合が校正よりも好まれるようにβヘアピンの位置をシフトさせる(Wang and Yang、2009)。 この修飾はおそらくこのポリメラーゼが翻訳合成の拡張を行うことを可能にする。, Polβは正確なDNAポリメラーゼであるため、結晶構造を知る前にはβヘアピンは大腸菌Pol IIよりもpol δの方が近いはずであると仮定されていましたが、驚くべきことに、polβのβヘアピンモチーフは短すぎてDNAに接触することができませんでした(図1)。 どのタンパク質モチーフは、その後、ミスペアのセンシング時に活性部位の切り替えを促進する可能性が Pドメインは、プライマーおよびテンプレート鎖の両方への接触のために、良い候補であり、Pドメインからの残基は、複製エラーを感知することができ、した,
結論
三つの真核生物複製DNAポリメラーゼはすべて共通のBファミリーフォールドを使用し、各ポリメラーゼは、各ポリメラーゼの特定の機能(例えば、PCNAを使用しないプロセッシブポリメラーゼであるpolβにおけるプロセッシブドメインの追加、または校正活性を欠いたポリメラーゼであるpol αにおけるテンプレートの5’endに接触する修飾領域)に合わせてユニークで仕立てられた修飾構造要素を組み込んでいる。 Bファミリーポリメラーゼのフォールドは、忠実度の高い複製性ポリメラーゼに適しています。, しかし、これだけのものでも用いられていますtranslesion polymerases. 真核生物のpolβ(またはREV3L)は、翻訳合成において機能し、腫瘍形成を抑制するように見える353kDaポリメラーゼである(Wittschieben et al.,2010;Lange et al.,2011;Zahn et al.,2011;Hogg and Johansson,2012;Sharma et al., 2013). 大腸菌Pol IIの構造は、エキソヌクレアーゼドメインのβヘアピンの位置に影響を与えるNTDの修飾を明らかにし、したがって重合および校正部位間のDNAの分割(Wang and Yang、2009)。, Polβの構造は、酵素があまり忠実で、翻訳合成を実行することができるレンダリングするために、高忠実度、複製ポリメラーゼによって採用される折り目を変
利益相反声明
著者らは、この研究が潜在的な利益相反と解釈され得る商業的または財務的関係がない場合に行われたと宣言している。
謝辞
この研究は、国立衛生研究所(NCI R01CA52040)からの助成金によって支援されました。
















コメントを残す