| The University of Sheffield | |
| Kemian | VSEPR |
Ammoniakki on myös neljä elektroni paria ja koordinoida geometria typen perustuu tetraedri järjestely elektroni paria. Sidottuja ryhmiä on vain kolme, joten yksinäisiä pareja on yksi. Koska yksinäiset parit ovat kuitenkin ”näkymättömiä”, ammoniakin muoto on pyramidimainen.,r>
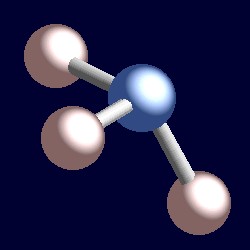
harkitse sitoutumisparia elektroneja. Nämä kaksi elektronia sijaitsevat kahden ytimen välissä, ja molemmat vetävät niitä puoleensa. Yksinäinen pari on erilainen. Se on välttämättä vain vetää yksi tuma ja seuraus on, että se ottaa kantaa tehokkaasti lähempänä, että yksi ydin kuin liimaus paria elektroneja. Tämä tarkoittaa, että yksinäisen parin käyttämä tehokas kiinteä kulma on suurempi kuin bond-parin miehittämä., Yksinäiset parit vaativat suurempaa kulmahuonetta, ja ne sijaitsevat lähempänä atomejaan kuin sidosparit. Tämän seurauksena ammoniakkia on, että lone-pair tekee tilaa itselleen työntämällä kolme vetyatomia yhteen hieman ja S-N-H-sidoksen kulmat ovat hieman vähemmän (106.6°) kuin ihanteellinen tetraedri kulma 109.5°.
















Vastaa