US Pharm. 2010;35(5):36-41.
suhde diabetes mellitus (DM) ja dementia on kiistaton, ja lukuisat tutkimukset ja totesi, että DM lisää riskiä kognitiivinen heikkeneminen ja dementia, mukaan lukien Alzheimerin tauti (AD).1-5 DM ei ainoastaan lisää dementiariskiä,se itse asiassa lisää dementian kehitysastetta kahdesta kolmeen.,3 mekanismi tämän vajaatoiminta ei täysin tunneta, mutta on arveltu, että hyperglykemia, insuliiniresistenssi, oksidatiivista stressiä, advanced glycation end tuotteita, ja tulehduksellisten sytokiinien kollektiivisesti johtaa kognitiivinen toimintahäiriö.5 itse asiassa diabetes kuvattiin ”erityinen eräänlainen kiihtynyt ikääntyminen” vuonna 1976, koska sen monet liittyvät komplikaatiot.,5 ilmeinen päällekkäisyys DM ja dementia on johtanut ehdotukseen, että MAINOS ei ole yksinomaan neurologinen häiriö, vaan pikemminkin neuroendocrine sairaus, jossa Steen et al coining termi tyypin 3 diabetes kuvaamaan tätä hybridi tauti.,6
Yleiskatsaus insuliiniresistenssi/Heikentynyt glukoosinsieto
Patofysiologia: Sekä heikentynyt glukoosinsieto—määritellään plasman glukoosi 140 mg/dL 199 mg/dL, kun suullinen testi glukoosinsieto ja heikentynyt paastoverensokeri—määritelty paasto plasman glukoosi 100 mg/l 125 mg/dL—ovat diagnostisten prediabetes (edeltäjä tyyppi 2 DM ), sellaisena kuin se on hemoglobiini-A1C 5,7% 6,4%.7 patofysiologia prediabetes on sama kuin T2DM, joka on diagnosoitu, kun paasto verensokeri 126 mg/dL tai enemmän tai A1C 6.,Vähintään 5% (testi toistetaan vahvistuksen saamiseksi).7 sekä ehtoja, insuliiniresistenssi kehittyy perifeerisissä kudoksissa, mihin insuliinia tarvitaan glukoosin otto (eli lihas -, maksa -, ja rasvaa), ja haima joutuu antamaan yhä enemmän insuliinia voittaa tätä vastarintaa.8 tässä vaiheessa, potilaat ovat usein hyperinsulinemic; kuitenkin ajan myötä, että haima ei pysty vastaamaan vaatimuksiin kudoksiin, ja insuliinia tuottavia beeta-solujen haima hitaasti onnistu, tuottavat yhä vähemmän insuliinia.,8 Ilman riittävää insuliinia, veren glukoosipitoisuus nousee, mikä johtaa prediabetes, ja jopa 70% potilaista, joilla prediabetes, T2DM.9 komplikaatioita hyperglykemia ovat moninaiset ja kattavat lisääntynyt riski makrovaskulaariset komplikaatiot (mukaan lukien sydäninfarkti, aivoverisuonitapahtuma, ja perifeerinen verisuonisairaus) ja mikrovaskulaarinen komplikaatioita (kuten nefropatia, neuropatia ja retinopatia).7
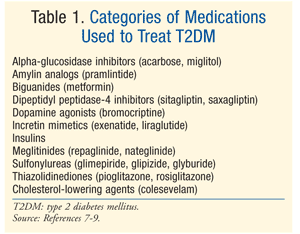
hoito: DM: n hoitoon on olemassa monia hoitoja., Hoidon alkuvaiheessa sekä prediabetes ja T2DM on elämäntapa muutos, johon ruokavalio, liikunta ja laihtuminen.7 American Diabetes Association (ADA) suosittaa myös huomioon metformiinin kanssa potilailla, joilla prediabetes, jotka ovat suuri riski sairastua diabetekseen.7 metformiinia suositellaan T2DM: n farmakologiseksi ensimmäiseksi hoidoksi.7 ada-glykeemisen tavoitteen saavuttamiseksi tarvitaan usein lisää farmakologista hoitoa, mukaan lukien A1C 7%.,7 On olemassa lukuisia luokkia lääkitys T2DM (TAULUKKO 1), ja valinta agentti normalisoimaan verensokeri riippuu isäntä potilas – ja lääkehoito-erityiset tekijät. On tärkeää huomata, että monet potilaat, joilla T2DM lopulta vaadi insuliinin saavuttaa ja ylläpitää euglycemia beta-solujen toimintaa vähitellen heikkenee.
Katsaus MAINOS
Patofysiologia: MAINOS on yleisin dementian muoto vanhemmilla aikuisilla, mikä vastaa 60% 80% kaikista tapauksista.,10 Kaksi histopatologisia tunnusmerkkejä AD ovat neuritic muistolaatat ja neurofibrillary tangles.11 plakkia koostuu liukenemattomasta beeta-amyloidiproteiinista. Solunsisäiset tanglit koostuvat fosforyloidusta tau-proteiinista. Tau-proteiini on tärkeä microtubule kokoonpano, ja kun tämä proteiini on poikkeuksellisen fosforyloitu, hermosolujen toiminta on keskeytynyt. Neurofibrillaariset vyyhdet vaikuttavat yleisimmin kolinergisiin neuroneihin.12 lisäksi keskeisen eksitatorisen välittäjäaineen, glutamaatin, häiriöt edistävät AD: n patologiaa., AD, on overactivation glutamaatin, signalointi, prosessi tunnetaan hermostoa, mikä johtaa plakin muodostumista, keskeinen hormoni inner kello tau-proteiinin ja solujen kuolema.12 yhteenvetona, hermostoa ja muodostumista neuritic muistolaatat ja neurofibrillary tangles häiritä välittäjäaine väyliä, jolloin oppimisen ja muistin heikkeneminen liittyy AD.
Hoito: saatavilla FDA-hyväksytty pharmacologic therapies AD on esitetty TAULUKOSSA 2.,11,12 Kun on vielä paljon opittavaa osalta hoitoja, jotka hoitaa tai muuttaa patologian MAINOS, tällä hetkellä saatavilla hoitoja, joissa käytetään asetyylikoliiniesteraasin estäjiä, joita on neljä, ja N-metyyli-d-aspartaatin reseptorin salpaaja memantiini.

Insuliini ja Aivot
Vaikka se on tarpeen glukoosia liikenne perifeerisissä kudoksissa, insuliini ei vaikuta tarvitaan glukoosin kulkeutumista aivoihin tai aivojen sokeriaineenvaihduntaan., Kun glukoosin kuljetus aivot eivät ole riippuvaisia insuliinia, insuliini itsessään on kuljettaa veri–aivoesteen (BBB) insuliinia reseptori–välitteisen kuljetuksen prosesseja.13 Tämä liikenne mekanismi on kyllästyvä, kun pitkäaikainen liiallinen insuliini pitoisuudet (hyperinsulinemia) periferiassa, kuten ne nähty prediabetes ja T2DM, tämä reseptori-välitteisen kuljetuksen mekanismi downregulates, mikä vähentää liikenteen insuliinin osaksi aivojen ja aivo-selkäydinnesteessä.,
lisäksi insuliinin, insuliinin kaltainen kasvutekijä tyyppi 1 (IGF-1) on läsnä aivoissa ja tarvitaan normaalin kasvun ja toiminnan keskushermostoon (CNS).14 Insuliini ja IGF-1-reseptoreihin sijaitsevat koko aivojen neuronien ja astrosyytit (tähden muotoinen solujen KESKUSHERMOSTOON, joka auttaa tukea neuronien aivoissa). Kaksi oppimisen ja muistin kannalta keskeistä aivojen aluetta, hippokampus ja hypotalamus, sisältävät suuria insuliinireseptoripitoisuuksia.5 rotilla intrakerebroventrikulaarisen insuliinin annostelun on osoitettu parantavan muistia.,15 lisäksi intranasaalisen insuliinin annostelun ihmisellä on todettu lisäävän muistin suorituskykyä.16 kuten aiemmin todettiin, insuliinia ei tarvita aivojen glukoosiaineenvaihduntaan; aivoissa voi kuitenkin olla tiettyjä alueita, joilla insuliini laukaisee glukoosiin liittyvät metaboliset prosessit. Rotilla tehdyissä tutkimuksissa insuliinin on osoitettu vaikuttavan glukoosin käyttöön hypotalamuksessa ja locus coeruleuksessa, kahdella oppimisen ja muistin kannalta tärkeällä alueella.,17 Oppiminen on myös osoitettu, helpottaa lisääntynyt ilmentyminen KESKUSHERMOSTO-insuliinin reseptoreihin, joka johtaa teoriaan, että läsnäolo ja aktiivisuus insuliinin aivoissa edistää ja pelata keskeinen rooli oppimisen ja muistin. Insuliini voi myös osaltaan modulaatio KESKUSHERMOSTON välittäjäaineiden, erityisesti asetyylikoliinin ja noradrenaliinin, jotka molemmat ovat tärkeitä normaalin kognition ja aivojen terveyttä.,18.
insuliiniresistenssi ja Dementia
Yleistä: Siellä näyttää olevan paljon vikoja insuliinin signalointi aivoissa AD-potilailla, jotka johtavat vähentynyt glukoosin käyttöä ja energia-aineenvaihduntaa.6,19 Kuin T2DM liittyy perifeerisen insuliiniresistenssin, MAINOS liittyy aivojen insuliiniresistenssi.20 AD: n alkuvaiheessa näyttää siltä, että insuliinin soluunotto ja signalointi aivoissa on riittämätöntä, mikä on merkki insuliiniresistenssistä.5,19,21,22 Lisääntynyt insuliinin reseptoreihin on nähty aivot AD-potilailla, todennäköisesti korvauksena insuliiniresistenssiä.,21
yleisesti ottaen tällä insuliininsignaloinnin heikentymisellä on monia vaikutuksia AD: n loppupään vaikutuksiin. Erään teorian mukaan pienet insuliinipitoisuudet keskushermostossa vähentävät asetyylikoliinitasoja ja aivoverenkiertoa.13 lisäksi muutokset insuliinipitoisuuksissa voivat edistää beeta-amyloidi-ja tau-proteiinin muodostumista.2 aivoissa insuliinia hajottava entsyymi (IDE) osallistuu beeta-amyloidiproteiinien hajoamiseen ja puhdistumaan.21 Korkea insuliini estää IDE, ja se voi johtaa lasku beeta-amyloidin välys, myöhemmin lisäämään aivojen laskeuman beeta-amyloidin.,5,19,21
viime Aikoina keramideja, perhe, lipidien, on käskenyt huomiota niiden mahdollinen rooli insuliiniresistenssi ja dementia.23,24 Keramideja syntyy tulehduksen, joka on yleinen lihavuus, T2DM, ja AD.24 koska seramidi läpäisee helposti BBB: n, altistuminen heikentää energia-aineenvaihduntaa ja muuttaa insuliinigeenin ilmentymistä, mikä edistää insuliiniresistenssiä.23,24 Tämä on tällä hetkellä aktiivinen kiinnostava alue, jossa tutkijat, jotka osoittavat, että estämällä synteesi keramidin estää lihavuus-välitteisen insuliiniresistenssiä.,24
intranasaalinen insuliini: kuten edellä mainittiin, intranasaalinen insuliinin anto parantaa muistin suorituskykyä ihmisillä.16 intranasaalista insuliinia on tutkittu useita kertoja. Kun hallinto 20 yksikköä intranasaalinen insuliini kahdesti vuorokaudessa ihmisten aiheista, Reger et al havaitsivat, että verrattuna lumelääkkeeseen, ryhmä hoitaa insuliini säilyttää enemmän suullista tietoa ja osoitti, parantaa huomiota ja toiminnallinen tila.,25 Nämä tutkijat totesi myös, että paasto plasman glukoosi ja insuliini ei muutu intranasaalinen insuliini käyttöön, mikä osoittaa, että intranasaalinen antotapa tarjoaa suoran insuliinin pääsy CNS ilman reuna vaikutuksia.25,26
PPAR-Gamma-Agonistit: Laajasti tutkittu perifeerisen insuliiniresistenssin, että tiatsolidiinidionien rosiglitatsonin ja pioglitatsonin tutkitaan niiden rooli hoidettaessa AD. Tiatsolidiinidionien ovat peroksisomiproliferaattorin aktivoitu reseptorien (PPAR)–gamma-agonistit., PPAR-gamma osallistuu glukoosi – ja lipidiaineenvaihduntaan ja moduloi tulehdusta, joka on tunnettu AD: n aiheuttaja.22,27 Tiatsolidiinidionia ovat insuliiniherkistäjiä, jotka pyrkivät vähentämään insuliiniresistenssiä; ne näyttävät myös vähentävän tulehdusta.21,26 useissa lumekontrolloiduissa tutkimuksissa rosiglitatsonihoitoa saaneilla potilailla muisti ja kognitiiviset toiminnot paranivat.21,22,28 vaikka pioglitatsonilla on tehty vain pieniä tutkimuksia, tähän lääkitykseen on liittynyt myös muistin ja kognition paranemista.,22 vaikka pioglitatsonin ja rosiglitatsonin BBB-läpäisevyys on huono, kaikki nämä aineet on dokumentoitu aivoissa oraalisen annon jälkeen.22 Vaikka nämä lääkkeet voivat pelata rooli ehkäisyyn tai hoitoon AD, ne eivät ole tällä hetkellä FDA-hyväksytty AD-potilailla, ja niiden mahdollisia hyötyjä ja riskejä on perusteellisesti harkita tapauskohtaisesti.
Aerobinen Liikunta: Ehkä tehokkain ja eniten huomiotta menetelmä vähentää insuliiniresistenssiä on fyysinen aktiivisuus., Lihavuuteen on liittynyt lisääntynyt insuliiniresistenssin, diabeteksen, dementian ja AD: n riski.29,30 liikunta parantaa insuliiniherkkyyttä ja alentaa perifeeristä insuliinitasoa.26,31 liikuntaan, painosta riippumatta, liittyy pienempi riski AD, joten se on ainoa todistettu neuroprotektiivinen hoito.29-31 mahdollinen mekanismi tämän neuroprotektioon on, että liikunta edistää puhdistuma beta-amyloidi proteiineja ja lisää aivojen hermokasvutekijän, kasvutekijä tärkeää kognitio ja hermosolujen selviytymistä, että on, vähentää MAINOS.,32
apteekkarin Rooli
Farmaseutit tärkeä rooli kouluttaa potilaille uusia hoitomuotoja; he tarvitsevat myös pysyä ajan tasalla uusia lääketieteellisiä löytöjä tai ehtoja, jotka on usein esitetty uutiset. Tyypin 3 diabetes on yksi tällainen sairaus. Kun on vielä paljon opittavaa tämä mahdollinen uusi yhteys diabetes ja heikentynyt kognitio, julkinen pyytää niiden terveydenhuollon tarjoajien lausunnon. Lisäksi monet diabetespotilaat ovat kiinnostuneita oppimaan lisää ja kääntyvät farmaseuttiensa puoleen saadakseen tietoa., Siksi, farmaseutit pitäisi keskustella nykyinen käsitys tämän ehdon potilaidensa kanssa ja myös neuvoa heitä noin strategioita, jotka voivat vähentää niiden riski, koska niiden yksittäisten perussairaus.
Johtopäätös
Intensiivinen tutkimus on käynnissä yrittää paremmin luonnehtia tyypin 3 diabetes ja kehittää ennaltaehkäiseviä ja terapeuttisia strategioita. Tähän mennessä ei ole erityisiä hoitoja, joilla on todistettua tehoa ehkäisyssä kognitiivinen heikkeneminen tai AD potilailla, joilla on DM., Näin ollen johdon kognitiivinen heikentyminen potilailla, joilla DM on sama kuin potilailla, joilla ei ole DM, jossa kiinnitetään erityistä huomiota glykeeminen kontrolli ja sydän-ja verisuonitautien riskitekijöitä. Tämä on sama lähestymistapa, joka on jo olennaisen tärkeä torjuttaessa DM: ään liittyviä komplikaatioita. Vaikka joillakin potilasryhmillä näyttää olevan lisääntynyt riski kognitiiviseen heikentymiseen, suurimmalla osalla potilaista, joilla on DM, ei ole hyvin määriteltyä kliinistä yhteyttä., Vaikka erityisiä hoitovaihtoehtoja ei ole saatavilla, nykyinen looginen lähestymistapa on glykeemisen kontrollin saavuttaminen ja kardiovaskulaaristen riskitekijöiden, kuten hyperlipidemian ja verenpainetaudin, huolellinen hallinta.
1. Stewart R, Liolitsa D. tyypin 2 diabetes mellitus, kognitiivinen heikkeneminen ja dementia. Diabet Med.
2. Xu WL, von Strauss E, Qiu CX, et al. Hallitsematon diabetes lisää Alzheimerin taudin riskiä: väestöpohjainen kohorttitutkimus. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabetes mellitus, dementia ja kognitiiviset toiminnot vanhemmilla henkilöillä., J Nutr Terveys Ikääntyminen. 2006;10:287-291.
4. Jacobson AM, Musen G, Ryan CM, et al. Diabeteksen ja sen hoidon pitkäaikainen vaikutus kognitiiviseen toimintaan. N Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. Tyypin 2 diabetes ja kognitiivisen heikentymisen ja dementian riski. Curr Neurol Neurosci Rep. 2007; 7: 373-380.
6. Steen E, Terry BM, Rivera EJ, et al. Heikentynyt insuliinin ja insuliinin kaltainen kasvutekijä ilmaisun ja signalointi mekanismit Alzheimerin tauti—tämä on tyypin 3 diabetes? Alzheimerin Tauti. 2005;7:63-80.
7. American Diabetes Association. Standards of medical care in diabetes—2010., Diabeteksen Hoito.
8. Triplitt Cl, Reasner CA, Isley WL. Diabetes mellitus. Julkaisussa: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmakoterapiaperiaatteet & käytäntö. 7.toim. New York, NY: McGraw Hill Medical; 2008: 1205-1241.
9. Nathan DM, Buse JB, Davidson MD, et al. Lääketieteellinen hoito hyperglykemia tyypin 2 diabetes: yksimielisyys algoritmi aloittamista ja säätö therapy: a consensus statement of American Diabetes Association and European Association for the Study of Diabetes. Diabeteksen Hoito.
10. Hebert LE, Scherr PA, Bienias JL, et al., Alzheimerin tauti Yhdysvalloissa: prevalence estimates using the 2000 census. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. Alzheimerin tauti. N Engl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill AM. Alzheimerin tauti. Julkaisussa: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmakoterapiaperiaatteet & käytäntö. 7.toim. New York, NY: McGraw Hill Medical; 2008: 1051-1065.
13. Craft S, Watson GS. Insuliini ja neurodegeneratiivinen sairaus: jaetut ja spesifiset mekanismit. Lancet Neurol. 2004;3:169-178.
14. de la Monte SM, Wands JR., Insuliinin ja insuliinin kaltaisen kasvutekijän ilmentymisen, signaloinnin ja keskushermoston toimintahäiriöiden tarkastelu: merkitys Alzheimerin taudille. Alzheimerin Tauti. 2005;7:45-61.
15. Park CR, Seeley RJ, Craft S, Woods SC. Intracerebroventrikulaarinen insuliini parantaa muistia passiivisen välttämisen tehtävässä. Fysiol Käyttäytyy. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et al. Neuropeptidergisten reittien manipulointi ihmisillä: uudenlainen lähestymistapa neurofarmakologiaan? Eur J Pharmacol. 2000;405:43-54.
17. Zhao WQ, Alkon DL. Insuliinin ja insuliinireseptorin rooli oppimisessa ja muistissa., Mol Cell Endocrinol. 2001;177:125-134.
18. Kopf S, Baratti C. Vaikutukset posttraining hallinto-insuliinin säilyttäminen sopeudutaan vastaus hiirillä: osallistuminen keski-kolinergisiin mekanismi. Neurobiol Opi Mem.
19. Revill P, Moraalinen MA, Prous JR. Heikentynyt insuliinin signalointi ja patogeneesi Alzheimerin tauti. Drugs Today (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Longato L, et al. Rajoitettu Alzheimerin tyypin neurodegeneraatio kokeellisessa lihavuudessa ja tyypin 2 diabetes mellituksessa. Alzheimerin Tauti. 2008;15:29-44.
21. Haan MN., Therapy insight: tyypin 2 diabetes mellitus ja myöhäisen Alzheimerin taudin riski. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar s, et al. PPARgamma-agonistit Alzheimerin taudin hoitoon käytettävinä terapeuttisina lääkkeinä. Neuroterapeutteja. 2008;5:481-489.
23. Lyn-Cook LE, Lawton M, Tong m, et al. Maksan ceramide voi välittää aivojen insuliiniresistenssi ja neurodegeneraatioon tyypin 2 diabetes ja alkoholittomat steatohepatitis. Alzheimerin Tauti.
24. Tong M, de la Monte SM. Seramidivälitteisen neurodegeneraation mekanismit. Alzheimerin Tauti.
25., Reger MA, Watson GS, Green PS. Intranasaalinen insuliini parantaa kognitiota ja moduloi beeta-amyloidia AD: n alkuvaiheessa. Neurologia. 2008;70:440-448.
26. Craft S. Insuliiniresistenssioireyhtymä ja Alzheimerin tauti: ikään ja lihavuuteen liittyvät vaikutukset muistiin, amyloidiin ja tulehdukseen. Neurobiolin Ikääntyminen. 2005; 26 (suppl 1): 65-69.
27. Jiang Q, Heneka M, Landreth GE. Peroksisomin proliferaattoriaktivoidun reseptori-gamma: n (PPARgamma) rooli Alzheimerin taudissa: terapeuttiset vaikutukset. Keskushermostolääkkeet. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, et al., Säilynyt kognitioon potilailla, joilla on varhainen Alzheimerin tauti ja amnestinen lievä kognitiivinen heikentyminen hoidon aikana rosiglitatsonin: alustava tutkimus. Olen J Geriatr Psykiatria. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. Adiposity ja Alzheimerin tauti. Curr Alzheimer Res. 2007;4: 127-134.
30. Whitmer RA. Adipositeetin ja dementian epidemiologia. Curr Alzheimer Res. 2007;4:117-122.
31. Watson GS, Craft S. insuliiniresistenssin rooli Alzheimerin taudin patogeneesissä: vaikutukset hoitoon. Keskushermostolääkkeet. 2003;17:27-45.
32. Cole GM, Frautschy SA., Insuliinin ja neurotrofisen tekijän rooli aivojen ikääntymisessä ja Alzheimerin taudissa. Exp Gerontol. 2007;42:10-21.
















Vastaa