Johdanto
Replikointi ydin soluille työllistää kolme DNA-polymerases: – polymeraasien α, δ ja ε (Hubscher et al., 2002; Pavlov et al., 2006b; Kunkel ja Hampurilaiset, 2008; Loeb ja Monnat, 2008; Hampurilaisia, 2009; Pavlov ja Shcherbakova, 2010; Lange et al., 2011)., DNA-synteesi on suuntaava ja etenee 5′ 3′, jossa nukleofiiliset hyökkäys α fosfaatti on nukleotidin 3 ’ OH primer tuloksia sisällyttäminen nukleosidi-monofosfaatti ja vapauttaa pyrofosfaatti (Steitz, 1999). Kaikki DNA-polymeraasit vaativat primerin ja vapaan 3 ’ OH: n DNA-synteesin tekemiseen, eikä pol α ole poikkeus. Pol α on heterotetrameeri, joka koostuu kahdesta primaasialayksiköstä ja kahdesta polymeraasialayksiköstä., Se primase alayksikön aloittaa DNA-replikaation syntetisoimalla lyhyt (7-12 ribonucleotides) RNA-alukkeet, jotka sitten pidentää polymeraasi α (Pellegrini, 2012). DNA-polymeraasi δ ja ε venyttää pohjamaalit syntyy pol α tarkka ja processive tavalla (Kunkel, 2004, 2011; Pellegrini, 2012). Hiiva, DNA-polymeraasi δ on osoitettu olevan välttämätön DNA-synteesin jäljessä strand toteaa, että pol ε näyttää lähinnä toiminto johtava strand (Pursell et al., 2007; Nick Mcelhinny et al., 2008; Kunkel, 2011; Georgescu ym., 2014)., Sen sijaan mitokondrioissa replikaatio on yhden ainoan polymeraasin, DNA-polymeraasin γ (Lee et al., 2009).
DNA-polymeraaseja on ryhmitelty seitsemän perhettä (A, B, C, D, X, Y, RT). Eukaryooteissa kolme ydinreplikatiivista DNA-polymeraasia sattuvat kuulumaan B-perheeseen (burgerit ym., 2001; Patel and Loeb, 2001). Siellä ovat nyt kiteitä rakenteita kaikki kolme replicative DNA-polymerases hiivasta, joka mahdollistaa ensimmäistä kertaa vertaamalla heidän yhteisiä rakenteellisia elementtejä sekä tutkimus niiden ainutlaatuinen ominaisuudet (Swan et al., 2009; Perera ym.,, 2013; Hogg ym., 2014; Jain et al., 2014a). Kaikki kolme replicative DNA-polymeraaseja on multi-alayksikkö entsyymejä (Taulukko 1) (Johansson ja Macneill, 2010; Pavlov ja Shcherbakova, 2010; Makarova et al., 2014). Pääpaino tässä tarkastelussa on niiden katalyyttinen verkkotunnuksen, tai alayksikön A.
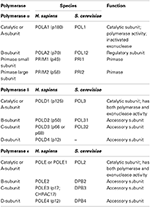
Taulukossa 1. Eukaryoottiset DNA-polymeraasit ovat monialaentsyymejä.,
Yleistä Rakenne B Perhe-Polymerases
Kaikki DNA-polymeraaseja on yhteinen polymeraasi kertaiseksi, joka on ollut verrattuna ihmisen oikea käsi, joka koostuu kolmesta aliverkkotunnukset: sormet, kämmen ja peukalo (Steitz, 1999; Patel ja Loeb, 2001). Palm, hyvin säilytetty taita koostuu neljästä antiparallel β-säikeet ja kaksi heliksejä, satamat kaksi ehdottomasti säilytettävä katalyyttinen aspartates sijaitsee motiivi ON, DXXLYPS ja motiivi C, DTDS (Delarue ym., 1990; Braithwaite ja Ito, 1993)., Tämä nopean toiminnan-kuten kansi on jaettu hyvin suuri joukko entsyymejä, mukaan lukien DNA-ja RNA-polymeraasien kanssa, reverse transcriptases, CRISPR-polymeraasi, ja jopa kääntää (3′-5′) transferaasien kuten Thg1 (Anantharaman et al., 2010; Hyde et al., 2010). Sen sijaan peukalon ja sormien alaotsikot ovat huomattavasti rakenteellisempia (Steitz, 1999). Sormissa tapahtuu konformaatiomuutos DNA: n ja oikean tulevan nukleotidin sitoutuessa. Tämä liike mahdollistaa jäämien sormien subdomain joutua kosketuksiin nukleotidin kanssa nascent emäspari., Peukalo pitää duplex DNA replikaatiota ja osallistuu processivity (Doublié ja Ellenberger, 1998; Doublié et al., 1999).
Eukaryoottisia DNA polymeraaseja α, δ ja ε jakaa homologia monet archaeal -, bakteeri bacteriophage, ja virusten polymeraasia (Delarue ym., 1990; Braithwaite and Ito, 1993; Franklin et al., 2001; Firbank ym., 2008; Wang and Yang, 2009)., Koonin ja yhteistyökumppaneita osaltaan yksityiskohtainen fylogeneettinen analyysi archaeal DNA-polymeraaseja ja niiden suhde aitotumallisilla-polymerases tässä numerossa Rajoja Mikrobiologian omistettu polymeraasien Makarova et al. (2014).
Kaikki B-perhe-polymerases koostuvat viisi aliverkkotunnukset: sormet, peukalo ja palm (kuvattu edellä), jotka muodostavat ydin-entsyymiä, sekä exonuclease, domain-ja N-terminal domain (NTD) (Franklin et al., 2001; Xia ja Konigsberg, 2014) (kuva 1; taulukko S1)., Eksonukleaasialueella on 3′ -5 ’ – oikolukutoiminta, joka poistaa harhaanjohtavia nukleotideja. Se exonuclease aktiivinen sivusto sijaitsee 40-45 Å päässä polymeraasi aktiivinen sivusto. NTD näyttää olevan vailla katalyyttistä toimintaa. Pol δ NTD koostuu kolmesta motiiveja: yksi on topologia muistuttaa OB-kertainen, yksijuosteisen DNA: ta sitova motiivi, ja toinen kantaa RNA-sitova motiivi (RNA Tunnustamisen Motiivi tai nopean toiminnan) (Swan et al., 2009). Bakteriofagissa T4 NTD: n mutaatiot vähentävät polymeraasin ilmentymistä (Hughes et al., 1987)., Rb69: ssä ja T4: ssä gp43-polymeraasi sitoo Oman lähetti-RNA: n, oletettavasti NTD: n kautta ja torjuu käännöksen (Petrov et al., 2002), joka ei näytä olevan pol δ: n (Swan et al., 2009). Uudet tiedot osoittavat, että NTD tärkeä rooli polymeraasi vakaus ja uskollisuus kautta sen vuorovaikutusta muiden verkkotunnuksia (Li et al., 2010; Prindle et al., 2013) (KS.alla).
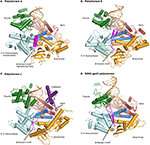
Kuva 1. Kolmen komponentin komplekseja-polymeraaseja α, δ, ε, ja RB69 gp43 on esitetty samanlaisten suuntausten vertailun., Peukalo (vihreä) ja sormet (tumma sininen) verkkotunnukset ymmärtää duplex nukleiinihappo (pohjamaali näkyy beige, malli oranssi) vastaan palm domain (punainen). N-terminaalinen domeeni esiintyy kullassa 3′-5′ – eksonukleaasialueen (Syaani) vieressä. (A) Polymeraasi α (PDBID 4FYD) sitoo RNA/DNA-hybridin, jossa leveä, matala minor groove-A-muoto DNA on ilmeisen lähellä peukalo. 3′ -5 ’ – eksonukleaasialue on vailla toimintaa. Inaktivoidun eksonukleaasin alueella oleva kierteinen alue (magenta) vakauttaa mallin 5 ’ etupuolen., (B) Polymeraasi δ (PDBID 3IAY) satamat suuri β hiusneula motiivi (magenta), mikä on tärkeää kytkentä pohjamaali lohkon päässä polymeraasi aktiivinen sivuston exonuclease aktiivinen sivusto, jos oikoluku. (C) Polymeraasi ε (PDBID 4M8O) käyttää ainutlaatuinen P-domain (violetti), joka hankkii polymerase lisääntynyt processivity. Mielenkiintoista on, että β-hiusneula-aihe on surkastunut pol ε: ssä., (D) Säilyttämistä perhe-B, DNA-polymeraasi-kertaiseksi, ja toimialueen organisaatio, on selvää, että kun malli entsyymin bacteriophage RB69 gp43 (PDBID 2OZS) on katsottu yhdessä kolme aitotumallisilla replicative-polymerases. Kunkin polymeraasin domeenidelineaatio on esitetty taulukossa S1. Kuva on tehty pymolilla (Pymol Molecular Graphics System, versio 1.5.0.4 Schrödinger, LLC.).
Kaikki nisäkkäiden B perhe DNA-polymeraaseja on tunnettu satama kahden kysteiini-rikas metalli sitova sivustoja (CysA ja CysB) niiden C-terminal domain (CTD) (Kuva 2)., Cysan oletetaan olevan sinkkiä sitova kohta, kun taas CysB on rautarikkiklusteri (Netz et al., 2012). Menetys klusterin CTD hiiva pol δ vaikuttaa negatiivisesti vuorovaikutus lisälaite B-alayksikkö (Sanchez Garcia et al., 2004). Sinkin sitomisaiheen osoitettiin olevan tärkeä pol δ: n ja sen processivity-tekijän, PCNA: n (Netz et al., 2012).

Kuva 2. Kaaviokuva kolme Saccharomyces cerevisiae replicative DNA-polymeraaseja α, δ ja ε., Bakteriofagi RB69: n DNA-polymeraasi esitetään vertailua varten.
DNA-Polymeraasi α:
katalyyttinen alayksikkö DNA-polymeraasi α koostuu 1468 aminohappoja (Taulukko 2). Proteiini rakentaa suunniteltu kiteytys oli katkaistu N – ja C-termini (jäämät 349-1258) ja siksi ei ole CTD ja sen klusterin (Kuva 2). Konstruktio oli kiteytynyt unliganded, binary monimutkainen DNA/RNA-hybridi oligonukleotidi, ja kolmen komponentin monimutkainen DNA/RNA ja saapuvat nukleotidin (Perera et al., 2013) (kuva 1).,

Taulukossa 2. Tunnetun rakenteen B-ryhmän DNA-polymeraasien kokoaminen.
Mekanismi Irtoamisen Polymeraasi
RNA/DNA-oligonukleotidi jää kiteet antaa A-lomakkeen rakenne, kuten odotettua. Peukalo-domainilla on useita interaktioita RNA primerin kanssa sekä hydrofobisten kontaktien että polaaristen interaktioiden (Perera ym., 2013)., Kokeiluja ratkaisu on osoittanut, että laajentaminen RNA-primer pol α on rajoitettu 10-12 nukleotidit, jonka suuruus on yhden kierroksen helix. Tämä havainto johti kirjoittajat ehdottavat mekanismia, irtisanominen, pohjamaali synteesin pol α jossa menetys erityisiä interaktio peukalon ja RNA johtaisi polymerase irrottaa DNA/RNA-oligonukleotidi, ja anna käden pois replicative-polymeraasi.,
Liikkeet Palm Verkkotunnuksen voi Helpottaa Translokaatio Pol α
Ottaa kiteytynyt entsyymin kolme valtiota (apo, binary, ja ternäärinen) saa kirjoittajat overlay kaikki kolme rakenteellisia malleja. Pol α on ainoa aitotumallisilla perhe-B, DNA-polymeraasi, jonka kaikki kolme valtiota olivat kiinni kiderakenne. Rakenteelliset päällekkäisyys paljasti, että lisäksi hyvin dokumentoitu liikkeet sormien ja peukalon aliverkkotunnuksia mukana substraatin sitova ja nucleotidyl siirto, palm aliverkkotunnuksen itse läpi rakenteellinen uudelleenjärjestely (Perera et al.,, 2013). Kirjoittajat ehdottavat, että eri conformations palm verkkotunnus voisi helpottaa translokaatio pol α pitkin ja sen jälkeen RNA/DNA-duplex. Kuten edellä mainittiin, yhteyksien häviämisen RNA-juosteeseen ennustetaan laukaisevan primerin vapautumisen, joka sitten tulee saataville jatkeeksi pol δ: lla tai ε: llä.,
Eri Proteiinia Taita Inaktivoitu Exonuclease Aliverkkotunnuksen
oikoluku toiminta on lakkautettu vuonna pol α, koska mutaatioita kaikki neljä carboxylates (Asp114/Glu116/Asp222/Asp327 vuonna RB69 gp43 vastaavat Ser542/Gln544/Tyr644/Asn757 rakenteeseen perustuva tasaus) (Taulukko 2). Lisäksi β-hiusneula motiivi löytyy eniten polymeraasien B-perhe (jäämät 246-267 vuonna RB69 gp43) korvataan kierteiset alueen pol α (jäämät 667-676; 681-693) (Hogg ym., 2007)., Β hiusneula on osa exonuclease verkkotunnuksen ja on osoitettu T4 ja RB69 pols osallistua osiointi DNA pohjamaali välillä polymeraasi ja exonuclease aktiivisen (Reha-Krantz, 1988; Stocki et al., 1995; Hogg ym., 2007). Ilman oikoluku toimintaa, se ei ole yllättävää, että tämä aihe ei ole säilytetty pol-α. Jäännökset Hänen 684 ja Phe 685 kierrejouset alueella pol α pino tymiini ja guaniini pohja, vastaavasti, kantoja, -3 ja -2 vuonna parittoman 5’end mallin (Perera et al., 2013)., Niinpä pol α alueen vastaavat β-hiusneula motiivi antaa eri kertaiseksi (heliksejä vs. β-säikeet) ja eri toiminto (vakauttava parittoman alueen malli strand sijaan helpottaa aktiivisen kytkentä). Koska pol α puuttuu oikoluku toimintaa, että herää kysymys siitä, onko lyhyt-oligonukleotidit ovat korjattu, ja jos näin on, jonka DNA-polymeraasi. Näyttää siltä, että oikoluku alukkeita syntetisoida pol α suoritetaan pol δ (Pavlov et al., 2006a).,
DNA-Polymeraasi δ
Ihmisen pol δ koostuu neljästä alayksiköstä ottaa huomioon, että Saccharomyces cerevisiae on kolme (Gerik et al., 1998; Liu et al., 2000) (Taulukko 1). Lisäksi sen tehtävä DNA-replikaation pol δ on osoitettu rooli DNA korjaus ja rekombinaatio (Hubscher et al., 2002; Lee ym., 2012; Tahirov, 2012). P12 -, pienin-alayksikkö ihmisen pol δ ja myös alayksikkö, joka ei ole nähnyt orastava hiiva, on hajonnut vastauksena DNA-vaurioita (Lee et al., 2014). Hiivan Pol δ (POL3) katalyyttinen alayksikkö koostuu 1097 jäämästä., Konstruktio käytetään kiteytys sisältää jäämiä 67-985 ja näin puuttuu CTD (Kuva 1; Taulukko 2).
Kolmas Metalli-Ioni-Polymeraasi Aktiivinen Sivusto
palm domain sisältää kolme säilytetty carboxylates (Asp608, Asp762, ja Asp764). Kaksi katalyyttinen aspartates, Asp608 ja Asp764, ota kaksi metalli-ionien (Ca2+) vuonna polymeraasi aktiivisen erotettu 3.7 Å. Kiehtovan kolmannen metalli havaittiin koordinoi γ fosfaatti saapuvan nukleotidin ja Glu802, jossa Glu800 läheisyydessä., Muuntuva sekä glutamaatteja, jotta alaniini tuotti polymeraasi variantti yhtiöittäminen vähentää tehokkuutta sekä oikean ja väärän nukleotidin (Swan et al., 2009). Nämä aminohappo kantoja, pol α ja pol ε on myös karboksylaatti jäännökset (pol δ Glu800/Glu802 vastaavat pol α Asp1033/Asp1035, ja pol ε Glu945/Asp947). On tutkittava, onko näillä karboksylaateilla samanlaisia rooleja pol α: ssa ja ε: ssä.,
Hifi-ja Oikoluku
Ihmisen pol δ on hifi-polymeraasi, katalysoi nucleotidyl siirtää reaktio virhe taajuus 1 per 22,000 (Schmitt et al., 2009). Oikoluku parantaa polymeraasin uskollisuutta kertoimella 10-100 (Mcculloch and Kunkel, 2008; Prindle et al., 2013). Pol δ satamat-polymeraasi ja exonuclease aktiivinen sivusto, erotettu noin 45 Å (Swan et al., 2009). DNA-polymeraasien kanssa, oikoluku toimintaa pystyvät aistimaan misincorporated nukleotidien ottamalla yhteyttä alaikäisen uraan emäsparin jälkeen lisäys-sivusto., Proteiini vuorovaikuttaa universaalien vetysidoksen hyväksyjien kanssa puriinien ja pyrimidiinien N3-ja O2-asennoissa (Seeman et al., 1976; Doublié ym., 1998; Franklin ym., 2001). Nämä vety-bond yhteystiedot säilyvät, kun emäsparin hyväksyy Watson-Crick geometria ja menetti siinä tapauksessa epäsuhta. Vuonna RB69 gp43, yhteystiedot, laajentaa ensimmäisen kahden emäsparin kuin orastavan emäsparin (Franklin et al., 2001; Hogg ym., 2004, 2005). Kontaktit ovat pol δ: ssa paljon laajemmat, ja ne ulottuvat viiden emäsparin jälkiasennukseen (Joutsen et al.,, 2009), joka voisi edistää sen uskollisuutta.
Kuten edellä mainittiin, β-hiusneula segmentin exonuclease domain on tärkeä rooli osio DNA: n välillä polymerointi ja oikoluku sivustoja T4 ja RB69 pols (Stocki et al., 1995; Hogg ym., 2007). Vuonna RB69 gp43 β-hiusneula motiivi antaa eri conformations, riippuen siitä, onko monimutkainen oli saatu ehjää DNA: ta (Franklin et al., 2001; Zahn ym., 2007) tai vahinkoa sisältävää DNA: ta (Freisinger et al., 2004; Hogg ym., 2004)., Se oli täysin visualisoitu yhteyttä sekä primer ja mallin säikeet monimutkainen tymiiniglykoli(Aller et al., 2011). Vastaavasti β hiusneula pol δ työntyy merkittävä ura DNA ja toimii kuin kiila välillä double-stranded DNA-ja single-stranded 5’end mallin strand, joka on vakiintunut kaksi aromaattinen jäämiä Phe441 ja Tyr446 (Kuva 1) (Swan et al., 2009). Β-hiusneulan sijainti on yhdenmukainen aktiivisen sivuston vaihdon kanssa.,
Interdomain Yhteystiedot ja Uskollisuutta
Mutaatioita mukana syöpä löytyy useimmiten exonuclease verkkotunnuksen pol δ ja ε, korostaen kriittinen rooli oikoluku alentaa esiintyvyys mutaatioita (Church et al., 2013; Henninger ja Pursell, 2014). Yksi mutaatio ihmisen paksu-ja peräsuolen syövän solut paikantuu sormet verkkotunnuksen, R689W. Analogisia mutaatio hiiva (R696W) tulokset mutaattorin fenotyyppi (Daee et al., 2010)., Mutaatio, jonka lähistöltä löytyy muun muassa Arg696 erittäin säilytetty motiivi B sormien aliverkkotunnuksen hiiva pol δ (A699Q) myös johtaa mutaattorin fenotyyppi. Tämä sormien alue on lähellä NTD: tä. Muuntuva Met540, että NTD että alaniini poistetaan mutaattorin fenotyyppi A699Q, mikä osoittaa, että vuorovaikutus sormet ja NTD voi vaikuttaa fidelity of polymerase (Prindle et al., 2013)., Vastaavasti T4 ja RB69 pols NPL ydin aihe, joka liittyy jäämiä N-terminaali ja palm verkkotunnuksia, on kosketuksissa sormet domain ja oli osoittanut, vakauttaa polymeraasi-DNA-kompleksit (Li et al., 2010).
DNA-Polymeraasi ε
katalyyttinen alayksikkö DNA-polymeraasi ε on tuote erittäin suuri geeni (2222 aminohappoja hiiva; 2286 ihmisillä), ja on vain kolmasosa koko jälkeen polymeraasi ζ (myös jäsen B perhe) ja pol θ, perhe-polymeraasi (3130 ja 2590 aminohappoja, vastaavasti, ihmiset) (Lange et al.,, 2011; Hogg ja Johansson, 2012) (Kuva 1; Taulukko 2). Pol ε on kaksi kertaa niin suuri kuin pol δ ja koostuu kahdesta tandem-polymeraasi/exonuclease alueilla. N-terminal-segmentin satamat sekä polymeraasi ja oikoluku toimintaa, kun taas C-terminal-segmentissä on inaktivoitu. Kaksi eksonukleaasi-polymeraasi-moduulia liittyvät etäisesti toisiinsa(Tahirov et al., 2009). Vaikka inaktivoitu segmentin oletetaan pelata rakenteellinen rooli aikana replikointi, kaksi ryhmää ovat voineet kiteytyä katalyyttisesti aktiivinen pol ε konstruktioita (jäämät 1-1228; 1-1187) puuttuu koko C-terminal module (Hogg ym.,, 2014; Jain et al., 2014a). Molemmat kiderakenteet olivat polymeraasin ternaarinen kompleksi, DNA primer/template ja saapuva nukleotidi.
uusi Processivity Domain peräisin Palm Domain
Pol ε eroaa pol δ siinä, että se ei vaadi DNA: n liukuva puristin PCNA korkea processivity (Hogg ja Johansson, 2012). Palm verkkotunnuksen pol ε on huomattavasti suurempi (380 jäämiä) kuin pol α δ (175 ja 203 jäämiä, vastaavasti)., Viime pol ε crystal rakenteet kävi ilmi, että lisäyksiä palm verkkotunnuksen yhdessä muodostavat uuden verkkotunnuksen, joka koostuu kolmesta β-säikeet ja kaksi heliksejä (jäämät 533-555; 682-760) (Hogg ym., 2014; Jain et al., 2014a) (Kuva 1; taulukko S1). Jäämien poistaminen 690-751 johti muunnokseen, jonka polymeraasiaktiivisuus väheni. Lisäksi fosfaattirungon läheisyydessä sijaitsevat positiivisesti varautuneet jäämät (His748, Arg749 ja Lys751)vaikuttivat entsyymin (Hogg et al., 2014)., Ylimääräistä domain peräisin palmu oli näin nimetty processivity tai P verkkotunnuksen, kun sen toiminta. P-domainin tyvessä on metallien sitomispaikka (KS. alla) (Hogg et al., 2014; Jain et al., 2014A, b).
Rauta Rikki Klusterin sisällä Polymeraasi Domain
Yllättäen ratkaisu tutkimuksissa kävi ilmi, että katalyyttinen alayksikkö hiiva-polymeraasi ε itsessään sisältää klusterin sisällä sen polymeraasi kertaiseksi (Jain et al., 2014b) CTD-klusterin lisäksi (kuva 2; taulukko 2)., Pol ε: n toinen klusteri viittaa siihen, että tämä polymeraasi voi olla herkempi oksidatiiviselle stressille (Jain et al., 2014b). Pol ε: n kiderakenteet eivät kuitenkaan paljastaneet klusteria polymeraasialueella (Hogg et al., 2014; Jain et al., 2014a; Zahn and Doublié, 2014). Kaksi kysteiinijäämistä on rakenteellisissa malleissa epäjärjestyksessä ja tuloksena oleva metallin sitoutumiskohta näyttää sitovan sinkkiä(Hogg et al., 2014; Jain et al., 2014a). A: n korvaaminen ei-alkuperäisellä sinkillä metalleja sitovissa proteiineissa ei ole epätavallista (Netz et al., 2012) klustereina ovat labiilit., Pol ε: n polymeraasialueen sisällä visualisointi voi vaatia anaerobisia olosuhteita.
Lyhyt β-Hiusneula Aihe Exonuclease Domain
kaikissa DNA-polymeraasi kätkeminen sekä polymeraasi ja exonuclease toimintaa, joka sitoo DNA: ta on tasapainossa kahden aktiivisia keskuksia (Beechem et al., 1998). Pitoisuus saapuvat nukleotidin ja läsnäolo vaurioitunut pohja tai mispair ovat kaksi tekijää, jotka vaikuttavat siirto DNA-polymeraasi aktivoida sivuston oikoluku aktiivinen sivusto., – Polymerases seurata minor groove puolella vastaperustetun emäsparia ja vuorovaikutuksessa universal H bond vastaanottajat, O3 -, ja N2-luokan ajoneuvoihin, koska tapa tarkistaa epäsuhta (Seeman et al., 1976; Franklin ym., 2001). Ainutlaatuinen ominaisuus pol ε on yhteyttä major groove puolella orastavan emäsparin kautta jäännös exonuclease verkkotunnuksen, Tyr431. Lisäanalyysi on tarpeen, jotta voidaan selvittää tämän tyrosiinin mahdollinen rooli pol ε: n hifistelyssä.,
pol δ β-hiusneula-segmentin insertit itse DNA: ta ja toimii kuin kiila välillä single-stranded ja kaksinkertaisen-pulaan DNA (Swan et al., 2009). E. coli-bakteerin DNA: ta pol II, lisätään β-tynnyri siirtyy kannan β hiusneula siten, että polymerointi on suosinut yli oikoluku (Wang ja Yang, 2009). Tämä muutos oletettavasti mahdollistaa tämän polymeraasin suorittaa translesionisynteesin laajennus., Koska pol ε on tarkka DNA-polymeraasi oletukseen, ennen kuin tietoa kiderakenne olisi, että β hiusneula pitäisi olla lähempänä, että pol δ kuin E. coli-Pol II. Yllättävää, β-hiusneula motiivi pol ε on katkaistu, liian lyhyt yhteyttä DNA: ta (Kuva 1). Mikä proteiini motiivi, sitten, saattaa helpottaa aktiivisen kytkentä, kun tunnistus on mispair? P domain on hyvä ehdokas, koska sen yhteystiedot sekä primer ja mallin osa; jäämiä P verkkotunnus voisi järkeä replikointi virheitä ja voi siten helpottaa aktiivisen kytkentä.,
Johtopäätökset
Kaikki kolme aitotumallisilla replicative DNA-polymerases käyttää yhteistä B-perhe-kertaiseksi, ja jokainen polymeraasi on sisällytetty muutettu rakenne-elementtejä, jotka ovat ainutlaatuisia ja räätälöityjä kunkin polymeraasi on tietty toiminto (esimerkiksi, lisäksi processivity domain pol ε, a processive-polymeraasia, joka ei käytä PCNA, tai muuttaa alueen yhteyttä 5’end mallin pol α, a-polymeraasi vailla oikoluku toimintaa). Taita B perhe-polymerases sopii hyvin hifi -, replicative-polymerases., Mutta yllättäen sitä käyttävät myös translesionipolymeraasit. Aitotumallisilla pol ζ (tai REV3L) on 353 kDa-polymeraasi, joka toimii translesion synteesi ja näyttää tukahduttaa tuumorigeneesiin (Wittschieben et al., 2010; Lange ym., 2011; Zahn ym., 2011; Hogg and Johansson, 2012; Sharma et al., 2013). Rakenne E. coli-Pol II paljasti muutoksia NTD, joka vaikuttaa kannan β hiusneula, että exonuclease verkkotunnuksen, ja näin erottua DNA: n välillä polymerointi ja oikoluku sivustoja (Wang ja Yang, 2009)., Rakenne pol ζ voi paljastaa vastaavia muutoksia, jotka muuttavat kertaiseksi palveluksessa hifi -, replicative polymeraasien tehdä entsyymiä vähemmän uskollinen ja osaa suorittaa translesion synteesi.
eturistiriita Lausunto
kirjoittajat ilmoittavat, että tutkimus on tehty ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisia eturistiriitoja.
tunnustus
tätä työtä tuki kansallisten Terveysinstituuttien (NCI R01 CA 52040) avustus.
















Vastaa