Johdanto
Intellectual disability (ID) vaikuttaa lähes 1-2% väestöstä ja on yleisin hermoston häiriö (NDD). Huomattavalla määrällä ID-potilaita todetaan olevan geneettinen syy(tarkasteltu Bessa et al., 2012)., Genome-wide-analyysi tekniikoita, joita käytetään tällä hetkellä tutkimus etiologia usein johtaa tunnistaminen erittäin harvinainen, lähes yksityinen vaihtoehdot, kokoelma potilaat, joilla on muutoksia sama geeni on keskeinen osa määritelmää uusi kliininen kokonaisuus.
Aiemmin tänä vuonna, potilaiden kätkeminen mutaatioita EBF3 geeni on kuvattu, esittelee hermoston oireyhtymä mukaan lukien TUNNUS, ataksia, hypotonia, lievä kasvojen dysmorphisms, ja urogenitaalinen poikkeavuuksia (OMIM 617330) (Chao et al., 2017; Harms et al., 2017; Sleven et al., 2017)., Se EBF3 (Varhainen B-solujen Tekijä 3) geeni koodaa jäsen hyvin säilyneitä varhaisen B-solu tekijä transkriptio tekijä perhe, joka ilmaistaan korkealla tasolla kehittyvä hermosto (tiedot noudetaan GTEx Portaali). EBF3 on transkription tavoite ARX, ja sen on osoitettu olevan säännelty NeuroD ja ARX (Friocourt ja Parnavelas, 2011). ARX koodaa transkriptio tekijä kriittinen alkion kehitystä, joka, monta vuotta, on liittynyt monenlaisia hermoston häiriöt., Henkisen vajaatoiminta, keskushermostoon ja virtsaelinten poikkeavuuksia havaittu potilaan kanssa sekä mutaatioita EBF3 ja ARX saattaa heijastaa osuus sekä proteiinien sama molekyyli-ja solutason prosessit (Chao et al., 2017). EBF3: n toimintaa on tutkittu myös eläinmalleissa. Ortologiensa ablaatio madoissa ja kärpäsissä johtaa neuronaalisen kehityksen heikentymiseen (Prasad ym., 1998; Hattori ym., 2013)., Hiirillä, tyrmäämällä Ebf3 johtaa vastasyntyneiden kuolleisuutta ja hermosolujen muuttoliike vikoja, vika -, haju neuronien hankkeen selkä -, haju-lamppu (Wang et al., 2004). Tarkka patogeeniset mekanismit EBF3 mutaatioita ei ole vielä täysin selvitetty, mutta tyyppi vaihtoehdot on kuvattu toistaiseksi viittaa siihen, että haploinsufficiency, voitto toiminto, ja hallitseva negatiivinen ovat mahdollisia patogeenisiä mekanismeja vaihtoehdot on kuvattu (Chao et al., 2017; Sleven et al., 2017).,
tässä työssä me edistää potilaan kanssa pienin poistaminen (600 Kb) ilmoitetaan päivämäärä vaikuttavat kokonaisuudessaan EBF3 geeni-ja kliinisen esityksen päällekkäisiä, että potilailla, joilla on EBF3 yhden nukleotidin variantteja (SNVs). Lisäksi teemme kliinisiä vertailu potilaat, joilla on aiemmin julkaistu suuri terminaali 10q poistot ja raportin, että vaikka erot koko on merkittävä fenotyypin päällekkäisyyttä potilailla, joilla näitä muutoksia., Nämä havainnot lisäävät tietoa EBF3 liittyvät häiriöt ja tuki EBF3 haploinsufficiency kuin avain hermoston oireyhtymä liittyy 10qter poistot.
Materiaalit ja Menetelmät
potilas oli todennut, sisällä suuri tutkimus hermoston häiriöt Portugalissa, jossa ilmoittautuminen potilaat ja perheet olivat tehneet viitaten lääkäri, kliiniset tiedot kerättiin nimetön tietokannan mukaan portugalin tietosuojaviranomainen (CNPD) ja kirjallinen suostumus oli saatu kaikille osallistujille., Äiti antoi nykyisen potilaan tietoon perustuvan suostumuksen geenitutkimukseen ja tulosten julkaisemiseen (mukaan lukien valokuvat). Tutkimuksen hyväksyi lääketieteellisen genetiikan Keskuksen eettinen komitea tohtori Jacinto Magalhães, kansallinen terveysinstituutti tohtori Ricardo Jorge.
genominen DNA uutettiin perifeerisestä verestä joko Citogene® DNA isolation kit-valmisteella (Citomed, Portugali). aCGH suoritettiin käyttäen Agilent 180 K-array (AMADID:023363) vastaan diploidi DNA viite (Kreatech on MegaPoll Viite DNA, Kreatech Diagnostiikka, Amsterdam)., aCGH analysis was performed using the Nexus Copy Number 6.0 software with FASST2 Segmentation algorithm (BioDiscovery Inc., El Segundo, CA). Genomic coordinates are according to Human Genome Build hg19. CNV confirmation was performed by qPCR for EBF3 (forward primer—CTCTCTGCTGGGTGCTGAG; reverse primer—GCGTCCCTTCATACGCTAAC; ENST00000368648.7) gene and using SDC4 (forward primer—ACCGAACCCAAGAAACTAGA; reverse primer—GTGCTGGACATTGACACCT; ENSG00000124145, Chr.20) and ZNF80 (forward primer—GCTACCGCCAGATTCACACT; reverse primer—AATCTTCATGTGCCGGGTTA; ENSG00000174255, Chr.3) as references genes., Analyysi tehtiin 7500 FAST Real Time PCR-laitteella (Applied Biosystems, Foster City, CA, USA) käyttäen Power SYBR Green® (Applied Biosystems, Foster City, CA, USA) mukaan valmistajan suositusten ja yleisten suuntaviivojen varten qPCR. Spesifisyys jokainen reaktio oli tarkistaa sukupolven sulaa käyrä kunkin täydennetty palasia. Pohjamaali hyötysuhde oli laskettu sukupolven standardi, käyrän sovitus hyväksytty normaali hyötysuhde prosentteina (alukkeita käytetään lueteltu Täydentävät Tiedot)., Jokaisesta testistä saadut Ct-arvot analysoitiin DataAssist™ – ohjelmistolla (Applied Biosystems, Foster City, CA, USA).
tulokset
tässä kuvataan potilasta, jolla on EBF3: een vaikuttava de novo-deleetio. Potilas on 11-vuotias tyttö, jolla on vakavia ID (globaalin kehityksen tulos = 27 klo 7-vuotiaat), syntynyt ei-consanguineous vanhemmat ja joilla ei ole suvussa hermoston häiriöt. Hän syntyi biamnioottisen bichorionisen kaksosraskauden (siskonsa ollessa terve) jälkeen emättimen kautta 35.raskausviikolla. Syntymäparametrit olivat: paino, 1 830 g (P3); Pituus, 42.,5 cm (P10) ja OFC 30,6 cm (P10), Apgar-pisteet 8/9 (1.ja 5. min). Vastasyntyneen kausi oli monimutkainen sepsiksen ja perinnöllisen sferosytoosin diagnoosin (periytynyt äidiltään) kanssa. Maailmanlaajuinen kehityksen viivästyminen havaittiin ensimmäisten kuukausien aikana, jolloin pään hallinta saavutettiin 12 kuukauden kohdalla, istuminen 18 kuukauden kohdalla, itsenäinen kävely 30 kuukauden kohdalla, eikä sanoja puhuttu 3 vuoden iässä., Hän oli pyelonefriitti klo 19 kuukautta (munuaisten ultraääni osoitti mitään poikkeavuuksia), gastroesofageaalinen refluksi ja toistuva välikorvatulehdus, johtavien kuulon menetyksen kanssa, että tarvitaan kirurgisia toimenpiteitä ja kuulolaite. Epilepsiaa epäiltiin 5 kuukauden kohdalla (keskeytysepisodit), mutta EEG oli normaali.
Hän oli ensimmäinen havaittu iässä 3 vuotta 5 kuukautta (Kuvat 1A,B), jolloin hän näkyy lihasten hypotonia, hypotoninen kasvot, karsastus, ja vähentää herkkyyttä kipua., Hän esitti myös lievä dysmorphic ominaisuudet (Kuva 1A): kolmion kasvot, pieni, matala-set korvat merkittävä anti-helix, kaareva kulmakarvat, anteverted nares, sipuli nenän kärki, pieni suu downturned kulmat, huomautti leuka, lyhyt kaula, ja näkyvä sormi sikiön tyynyt, sekä lievä lyhytkasvuisuus (89 cm, mikä vastaa noin 2SD).

Kuva 1. (A) Kasvojen ulkonäkö potilaan 3 vuotta ja 5 kuukautta, osoittaa pieni ja matala-set korvat merkittävä anti-helix ja (B) sikiön tyynyt sormet., (C) potilaan kasvojen ulkonäkö 11-vuotiaana. (D) Korostetaan, harmaa 600 Kb poisto tällä 10q26.3-alueella; zoom-in EBF3 geeni POV tietokanta paljastaa olemassaolon 3 poistot 3 valvonta, joka vaikuttaa ensin eksonien 6 ja EBF3 (NM_001005463); CNVs tällä alueella löytyy ohjaus populaatioiden poistot nvs825626 (läsnä 1/31 yksilöitä), nvs552315 (läsnä 1/17421 yksilöitä) ja nsv552316 (läsnä 1/31 henkilöitä). E) EBF3: n selostusten kaavamainen esitystapa.,
Aivojen MRI suoritettiin 6 vuotta, mutta ei poikkeavuuksia havaittu. Hän oli 10-vuotiaana uudelleenarvioitu; hänellä oli edelleen toistuvia välikorvatulehduksia, mutta muuten hän oli hyvässä globaalissa kunnossa. Kieli oli erittäin huono (kaksi sanalausetta puhuttiin 8 vuoden jälkeen). Hän oli käyttäytymisen ongelmia, kanssa stereotyyppistä liikkeet (pyörivä liikkeitä, pureskelee vaatteita, pää retropulsion), pisteytys vaikean autismin kirjon häiriö (ADI-R ja ADOS) 7 vuotta; hän näkyy levottomuus ja aggressiivinen käytös (auto ja hetero) ja oli lääkkeitä antipsykoottisia lääkkeitä., PES planukselle tehtiin ortopedinen leikkaus. Kasvojen piirteet olivat samanlaisia kuin aiemmin kuvattu, toisistaan erillään ylempi keski etuhampaat (Kuva 1C); hän oli silmälasit varten karsastus ja hypermetropia.
Analyysi genomien DNA aCGH paljasti de novo 600 kb poisto tällä 10p26.3 (Kuva 1D) vaikuttaa kolme geeniä—MGMT (koodaus entsyymi O-6-methylguanine-DNA-metyylitransferaasin, mukana DNA: n korjaus), EBF3 ja GLRX (koodaus glutaredoxin, pieni thioltransferase, että poistaa proteiinia GSH adduktien), josta EBF3 oli todennäköisesti tauti-liittyvän geenin.,
Keskustelu
acgh analysoi potilaan ensimmäisen kerran muutama vuosi sitten. Tuolloin aCGH-analyysi, olemassa kolme variantteja läsnä Tietokanta Genomista Variantteja (POV)1 vaikuttaa ensimmäisen viiden eksonien ja EBF3 geeni (Kuva 1E; Park et al., 2010; Cooper ym., 2011), sekä ilman muiden tiedossa sairautta aiheuttavat mutaatiot tässä geenissä, johtaa meidät luokitella sen variantti tuntematon merkitys (VOUS). Kuitenkin viimeaikaiset julkaisut EBF3 mutations (Chao et al., 2017; Harms et al., 2017; Sleven et al.,, 2017) ja kliinisen yhtäläisyyksiä raportoitu tapauksissa, johtaa meidät arvioimaan uudelleen, variantti ja saada meidät uskomaan, että EBF3 poistaminen voi itse asiassa olla mikä sairaus potilaalla. Yksi näkökohtia, jotka epäili, patogeenisuus tämä variantti ensimmäinen paikka oli olemassa väestön valvontaa laakeri poistot kuuden ensimmäisen eksonien tämän geenin, vuonna heterotsygoottisuuden (tiedot noudetaan POV tietokantaan. helmikuuta 2017) (Kuva 1D). Vaikka transkriptio EBF3 alkaen Exon13b on lueteltu Ensembl-tietokanta (ENST00000440978.,1) (Kuva 1E), joka voisi selittää, miten poistetaan ensimmäinen eksonien voisi lopulta johtaa normaalin fenotyypin, tämä transkriptio ei sisällä DNA: ta sitova domeeni EBF3, ja sen ilme malli ja toiminnallinen merkitys ei ole ominaista. Uudelleenarvioinnin yhteydessä Cooperin ja kollegojen (nsv552315 ja nsv552316) (Chao et al., 2017; Harms et al., 2017; Sleven et al.,, 2017) katsottiin olevan kynnys havaitseminen SNP microarray ja voi olla perusta ulkopuolelle ehdokas geeni, erityisesti valossa vahva geneettinen ja toiminnallinen todisteita merkitystä EBF3 mutaatioita tauti (Evan Eichler, Greg Cooper ja Bradley Coe, henkilökohtainen tiedonanto).,
– Meidän potilas osoittaa monia kliinisiä yhtäläisyyksiä aiemmin kuvattu potilaat, joilla on mutaatioita EBF3 (21 tapausta yhteenveto Taulukossa 1), kuten globaalin kehityksen viivästyminen, viivästynyt ilmeikäs puhe, hypotonia, lisääntynyt kipu kynnys, käyttäytymisen ongelmia ja ominaisuus kasvonpiirteet (pitkä/kolmion kasvot, suuri otsa, hypotoninen kasvot)., Vaikka potilaan motorinen kehitys viivästyi merkittävästi, merkittävää ataksiaa ei kuitenkaan havaittu (joitakin rajoituksia kliinisessä tutkimuksessa, koska lapsi ei ollut yhteistyöhaluinen), eikä aivojen magneettikuvauksessa ollut pikkuaivojen poikkeamia.

Taulukossa 1. Kliinistä vertailua tähän tapaukseen verrattuna raportoituihin tapauksiin, joissa EBF3-geenin pistemutaatioita/indellejä esiintyi.
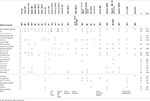
Taulukossa 2., Käsiteltävänä olevan tapauksen kliininen vertailu raportoituihin tapauksiin, joissa poistot vaikuttavat 10q26 sytokaistaan.
EBF3 vaihtoehdot on kuvattu kirjallisuudessa vuoden 2017 alussa ovat pistemutaatioita ennustettu olevan haitallisia ja pieniä lisäyksiä ja poistoja, mikä runko poistetaan avain aminohapot tai frameshift, ennustettavasti aiheuttaa varhainen katkaisu tuloksena proteiinia tai hölynpölyä-välitteisen hajoamisen., Mutaatiot olivat keskittyneet osat geeni, joka koodaa DNA-binding domain EBF3, ja ennustettiin läpi eri menetelmiä johtaa menetykseen toiminto tämä transkriptio tekijä, mikä viittaa siihen, alennettu toimintaa ja haploinsufficiency kuin taustalla oleva mekanismi hermoston häiriöitä näillä potilailla. Knock-out-hiirillä Ebf3 on kuvattu esittää vastasyntyneiden kuolleisuutta ja hermosolujen muuttoliike vikoja, vika -, haju neuronien hankkeen selkä -, haju-lamppu (Wang et al.,, 2004), mutta ei kuvaus on tehty fenotyyppi heterotsygoottisessa eläimiä, jotka ovat itse asiassa esitetty valvontaa monissa kokeissa, mikä ei tue haploinsufficiency malli. Olemme pyrkineet saada ja tutkia hermoston fenotyyppi nämä eläimet, mutta ei onnistunut, koska Ebf3(O/E2) knock-out line voi olla lopetettu (Joseph W. Lewcock, henkilökohtainen tiedonanto). Kuitenkin, nykyinen asia yhdessä potilaiden kanssa esitetty Taulukossa 2, eivät tue hypoteesi EBF3 haploinsufficiency kuin sairaus, joka aiheuttaa.,
yhteenvetona, nykyinen kuvaus vahvistaa EBF3 menetys toiminto/haploinsufficiency aiheuttaa hermoston sairaus, ja vahvistaa yhdistyksen tämän geenin tyypillinen kliininen oireyhtymä tämän spektrin.
Kirjoittaja Maksut
FL suorittaa molekyyli tutkimukset ja analysoida molekyylitason tiedot. MG ja GS keräsivät kliinistä tietoa. FL, JP ja PM tarkastelivat kaikkia EBF3-mutaatiotapauksia kirjallisuudessa. FL, GS, JP ja PM laativat lehden. PM sai rahoitusta tähän tutkimukseen. Tutkimus tehtiin PM: n johdolla.,
Rahoitus
FCT—Fundação para a Ciência e a Tecnologia sisällä hankkeet ja apurahat (PIC/IC/83026/2007, PIC/IC/83013/2007, SFRH/BD/90167/2012). Tämä artikkeli on kehitetty hankkeen laajuuteen NORTE-01-0145-FEDER-000013, jota Pohjois-Portugali Alueellisen Toimintaohjelman (NORTE 2020) mukaisesti Portugali 2020-kumppanuussopimuksen kautta Euroopan aluekehitysrahaston (FEDER).
Eturistiriitaselvitys
JP oli CGC Geneticsin palveluksessa.,
muut kirjoittajat ilmoittavat, että tutkimus on tehty ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisia eturistiriitoja.
Kiitokset
Haluamme kiittää potilaan ja hänen perheensä osallistumista geneettiset tutkimukset ja huomasi tämän julkaisun. Olemme kiitollisia Tohtori Ana Maria Fortuna ja Tohtori Margarida Reis Lima tehdä tämän hankkeen mahdollista ja helpottaa meidän yhteistyötä CGM.
Alaviitteet
1., ^Genomivarianttien tietokanta saatavilla osoitteessa: http://dgv.tcag.ca/dgv/app/home .
Friocourt, G., ja Parnavelas, J. (2011). Arx-tavoitteiden määrittely paljastaa uusia ehdokkaita aivokuoren sisäisen maahanmuuton ja eriyttämisen valvomiseksi. Edessä. Solu. Neurologi. 5:28. doi: 10.3389 / fncel.2011.00028
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar
















Vastaa