Hallinta äitien alloimmunization
pääsääntöisesti serial äidin vasta-ainepitoisuuksia seurataan, kunnes kriittinen tiitteri 1:32, mikä osoittaa, että korkea riski sikiön hydrops on saavutettu. Tässä vaiheessa sikiö vaatii erittäin voimakasta seurantaa anemian ja sikiön hydrops-oireiden varalta., Vuonna Kell alloimmunization, hydrops voi esiintyä pienillä äidin tiitterit koska tukahdutetaan punasolujen, ja siten tiitteri 1:8 on ehdotettu kriittinen. Siksi myös Delta-OD 450-arvot ovat epäluotettavia, kun ne ennustavat sairauden vakavuutta Kell alloimmunisaatiossa.
äidin titterit eivät ole hyödyllisiä ennustettaessa sikiön anemian puhkeamista ensimmäisen sairastuneen tiineyden jälkeen. Suuria eroja titteri voidaan nähdä saman potilaan eri laboratorioiden välillä, ja uudempi geeli tekniikka tuottaa korkeampi tiitteri tuloksia kuin vanhemmat putki-menetelmällä., Siksi, vakio putki menetelmää tulisi käyttää määrittää kriittinen titteri, ja muuttuu enemmän kuin 1 laimennus edustaa todellinen kasvu äidin vasta-ainetiitteri. Kaikki vasta-aineita vastuussa hemolyyttinen sairaus vastasyntyneen (HDN), 4-kertainen mitään vasta-ainetiitteri on tyypillisesti pidetään merkittävä muutos, joka edellyttää sikiön arviointi.
Kun ilmoitettu, amniocentesis voidaan suorittaa jo 15. raskausviikolla (harvoin tarvitaan ensin vaikuttaa raskauden ennen 24. raskausviikolla) määrittää sikiön genotyypin ja arvioida vakavuus., Äidin ja isän verinäytteet tulee lähettää vertailulaboratorion kanssa lapsivesi näytteen poistaa vääriä positiivisia tuloksia (äidin pseudogene tai Ccde-geeni) ja vääriä negatiivisia tuloksia (alkaen uudelleenjärjestely klo RHD-geenin locus isä).
Sikiön Rh-genotyypin määritys äidin plasma on tullut rutiinia monissa Euroopan maissa ja tarjotaan yhdysvalloissa., Sikiön soluvapaa DNA: n osuus on 3% koko verenkierrossa äidin plasman DNA: ta on löytynyt jo 38 päivää raskausviikolla, ja on johdettu apoptoosin ja istukan cytotrophoblast kerros. Keskimääräinen puoliintumisaika verenkierrossa sikiön DNA on keskimäärin alle 30 minuuttia, ja äidin plasman tehdään suodatus ja microcentrifugation poistaa kaikki solujen elementtejä ennen testausta. Tämä eliminoi vääriä positiivisia tuloksia engrafted sikiön solujen aiemmista raskauksista äidin lymfoidisissa elimissä.,
Cell-free sikiön DNA kohdistuu reaaliaikainen polymeraasiketjureaktio (PCR) läsnäolo RHD-geenin–spesifisiä sekvenssejä, ja sen on todettu olevan tarkka 99.5% tapauksista. Että SRY-geeni (mies sikiö) ja DNA-polymorfismit väestössä (naisen sikiö) käytetään sisäisen valvonnan vahvistaa sikiön alkuperää cell-free DNA: ta. Paneeli 92 yhden nukleotidin polymorfismien (snp) on verrattuna välillä äidin näyte buffy coat-ja plasma., Ero yli 6 SNPs vahvistaa läsnäolo sikiön DNA: ta ja testin validiteetti naisen sikiö. Väärät-negatiiviset tulokset ovat kaikkein epätoivottavimpia ja johtuvat osittaisista tai heikoista d-fenotyypeistä. Ne havaitaan käyttämällä vähintään kahta RHD-erityisiä eksonin pohjamaalit ja ajaa kaksoiskappaleet.
Onneksi, solu-ilmainen sikiön DNA-testaus, jolla määritetään genotyyppi muita punasolujen antigeenejä, kuten c -, C -, e -, E-ja Kell on nyt myös todettu olevan erittäin luotettava ja tarkka.,
sarja amniocentesis aloitetaan 10-14 päivän välein taudin vakavuuden seuraamiseksi sikiössä. Kaikki pitäisi yrittää välttää kulkeutuvan istukan läpi neula, joka voi johtaa fetomaternal verenvuoto (FMH) ja edelleen nousu vasta-ainetiitteri. Sarja delta-OD 450 arvot piirretään Queenan kaavio tai laajennettu Escalona kaavio arvioida riski sikiön hydrops. Varhainen ultraäänitutkimus suoritetaan oikean raskausiän määrittämiseksi., Usein ultraäänitutkimuksessa seuranta suoritetaan myös arvioida sikiön hyvinvointia ja havaita kohtalainen anemia ja varhaisia merkkejä hydrops.
huippu systolinen keskimmäisen aivovaltimon (MCA) Doppler-velocity on osoittautunut luotettava seulonta työkalu havaita sikiön anemia ja on korvannut lapsivesitutkimus. MCA on helposti näkyviksi väri-Doppler; Doppler käytetään sitten mitata huippu systolinen nopeus vain distaalinen sen kaksijakoisuus sisäisen kaulavaltimon., Koska MCA nopeus kasvaa etenee gestaatioikään, tulos on raportoitu kerrannaisina mediaani (MOMs). Viimeaikaisissa tutkimuksissa keskivaikean ja vaikean sikiön anemian havaitsemisherkkyyden on osoitettu olevan 100%, ja väärän positiivisen 10% 1,5-äidin kohdalla. Sen on osoitettu vähentävän invasiivisten diagnostisten menetelmien, kuten amniocentesis ja cordocentesis, tarvetta yli 70%.
MCA Doppler-tutkimukset voidaan aloittaa jo 18 raskausviikolla, mutta eivät ole luotettavia jälkeen 35 raskausviikolla., Se on myös käytetty aikaa myöhemmin sikiön verensiirtoon ja diagnosoida anemia useista syistä, kuten twin-twin verensiirron. MCA-rinnettä 3 viikon mittaisista lukemista käytetään nyt ennustamaan sikiön vakavan anemian riskiä (KS.alla oleva kuva).
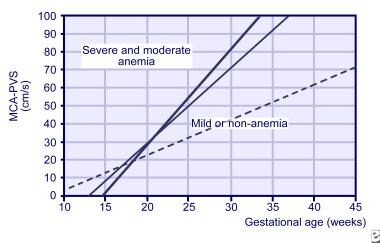 Rinteitä huippu systolinen nopeus keskimmäisen aivovaltimon (MCA) normaali sikiöiden (katkoviiva), lievästi aneeminen sikiöiden (ohut viiva), ja ankarasti anemia sikiöiden (paksu viiva).,
Rinteitä huippu systolinen nopeus keskimmäisen aivovaltimon (MCA) normaali sikiöiden (katkoviiva), lievästi aneeminen sikiöiden (ohut viiva), ja ankarasti anemia sikiöiden (paksu viiva)., hankittaessa kokemusta MCA Doppler-tutkimuksen suorittamisesta, sarjamuotoista amniocentesis sikiön anemian havaitsemiseen on käytetty vähäisemmässä määrin.
Aikana, jolloin kohdunsisäinen vatsakalvon verensiirron oli ainoa keino hoidon, vastasyntyneet olivat rutiininomaisesti toimitettu 32 raskausviikolla. Tämä lähestymistapa johti korkea esiintyvyys hyaliinimembraanitauti ja vaihto verensiirtoja., With kynnyksellä intravaskulaarinen verensiirtoon (IVT) kohdussa, yleinen lähestymistapa vakavasti vaikuttaa sikiöön on suorittaa ammatillisen PERUSKOULUTUKSEN kuin tarvitaan, kunnes 35 raskausviikolla, toimitus suunnitteilla aikavälillä. Perustaminen keuhkojen kypsyys on vaikeaa nämä sikiöt, koska saastumisen lapsivesi, jossa jäljellä verta verensiirron aikana; kuitenkin, jos toimitus on suunniteltu ennen 34 raskausviikolla, äidin steroidi hallinto parantaa sikiön keuhkojen kypsyys on ilmoitettu.,
lisäksi ylimääräinen lapsivesi bilirubiini aiheuttaa vääriä korkeuden fluoresenssi depolarisaatio TDx sikiön keuhkojen kypsyys-testin version II (TDX-FLMII); siksi muut kokeet määrittää sikiön keuhkojen kypsyys tulisi käyttää, kuten infrapuna-spektroskopia, lamellaarisia body count, phosphatidylglycerol quantitation tai lesitiini/sfingomyeliini (L/S) suhde.
Escalona ensimmäinen kuvattu vatsaonteloon verensiirtoon (IPT) vuonna 1963. Sikiön vatsakalvononteloon tuodaan Tuohy-neula ultraäänitutkimuksessa., Epiduraalikatetri pujotetaan neulan läpi. Sikiön vatsakalvoon ruiskutetaan radioaktiivista ainetta. Oikea sijoitus vahvistetaan rajaamalla suolen ulkopuolelle tai pallean alle tai diffuusiolla sikiön askiteissa.,ss-kuin 4-päivää-vanha, O-ryhmän Rh-negatiivinen, Kell-negatiivinen, leukoreduced, säteilytetään 25 Gy estää graft versus host disease, ja cross-sovitettu äidin seerumin ruiskutetaan 10 mL: n näytettä, tilavuus lasketaan seuraavalla kaavalla:
IPT tilavuus = (tiineyden viikkoa – 20) × 10 mL
Jäljellä oleva hemoglobiini (Hb) sikiöön on arvioitu, jotta oikea väli IPT ja valinta tiineyden toimitus seuraavalla kaavalla:
Hb g/dL = 0.,85/125 × a/b × 120 – c/120
kaavan on määrä luovuttajan RBC Hb verensiirtoa, b on arvioitu sikiön paino, ja c on aikaväli päivinä alkaen, kun verensiirron ajan luovuttajan Hb arvio.
IPT on toistuva, kun sikiön Hb on arvioitu laskeneen 10 g/dL. Yleensä toinen IPT suoritetaan 10 päivää ensimmäisen verensiirron jälkeen, jotta Hb nousee yli 10 g/dL. Sitten toinen verensiirto suoritetaan 4 viikon välein, kunnes aika suunniteltuja toimitus 34-35 raskausviikolla., Sikiön pallealiikkeet ovat välttämättömiä RBC: n imeytymisen kannalta. Tämä lähestymistapa ei ole arvokas moribund nonbreathing sikiö. Äidin komplikaatioita ovat infektio ja kulkeutuvan verenvuoto, kun taas sikiön komplikaatioita ovat overtransfusion, verenhukka, sydämen tamponaatio, infektio, ennenaikaisen synnytyksen, ja graft versus host disease. ITPT: n jälkeiset eloonjäämisasteet lähestyivät noin 75% ultrasonografian avulla.,
Suora IVT on tullut ensisijainen reitti sikiön interventio, koska korkeampi komplikaatioita ja rajallinen tehokkuus IPT on hydropic sikiölle. Rodeck esiintyi ensimmäisen kerran menestyksekkäästi IVT: ssä vuonna 1981. Kanssa ultraäänitutkimuksessa opastusta, 20-22 mittari neula on otettu käyttöön osaksi napalaskimon johto lisäys osaksi istukan tai sen intrahepaattinen osa, ja sikiön veren näyte on saatu. Verinäytteen on vahvistettu olevan sikiöperäistä pikaisella emäksisellä denaturaatiotestillä., Kaikki asiaankuuluvat sikiön testit (esim. veriryhmä, suora-ainetesti, retikulosyyttien määrä, verihiutaleiden määrä, Hb-taso, Hct tasolla, seerumin albumiini tasolla, erytropoietiini-taso) suoritetaan. Jos Hb-taso on alle 11 g/dL tai jos Hct-taso on alle 30%, IVT on alkanut. Neulan asento vahvistetaan toteamalla sikiön verisuonen turbulenssi suolaliuoksen ruiskutuksessa. Sikiö on usein halvaantunut kanssa pancuronium ja koska fentanyyli 10 mikrog/kg estämään siirtyminen neula sikiön liikkeet., Äidin lääkitys vaihtelee vain paikallispuudutuksessa, rutiininomaiseen indometasiiniin ja tietoiseen sedaatioon, selkärangan epiduraalianalgesiaan.
verensiirto suoritetaan 10 mL: n näytettä, tilavuus on noin 50 mL/kg arvioitu kehon painoa käyttäen ultraääni tai kunnes Hct-taso 40% on saavutettu. Toimenpide keskeytetään välittömästi, jos ultraäänitutkimuksissa havaitaan sydämen dekompensaatiota., Vakavasti aneemiset sikiöt eivät siedä Hct: n akuuttia korjaamista normaaliarvoihin, eikä alkuperäistä Hct: tä pitäisi lisätä yli 4-kertaiseksi ensimmäisen IVT: n aikana. Niitä tulee sitten seurata 2-7 päivän välein. IVT toistetaan, kun se saavuttaa arvon, joka heijastaa kriittistä anemiaa sikiössä. Siirretyistä soluista voidaan olettaa häviävän 1% päivässä.
jotkut keskukset suorittavat toistuvaa verensiirtoa 10 päivän, 2 viikon ja 3 viikon välein. Muut verensiirto perustuu odotettu lasku sikiön hemoglobiini 0,4 g/dL/päivä, 0,3 g/dL/päivä, ja 0.,2 g/dL/vrk ensimmäisen, toisen ja kolmannen verensiirron välein. Systolisen MCA-nopeuden huippu on käytetty toisen verensiirron ajoittamiseen, jonka kynnys on 1,32 äitiä. Kun ensimmäinen kohdunsisäinen verensiirto, läsnäolo punasoluja aikuisten hemoglobiini tukahduttaa punasolujen ja parantaa hapen toimitus, joka on vastuussa huono korrelaatio huippu MCA nopeus ja vakavuus sikiön anemia. Jotkut keskukset ovat havainneet hyödylliseksi yhdistää IVT ja ITT verensiirto välillä toistaa verensiirto.,
lisäksi komplikaatioita IPT, ohimenevä sikiön bradykardia, johto hematooma, napalaskimon puristus, ja sikiön kuolema, on raportoitu vuoden IVT. Kuitenkin, IVT on monia etuja, mukaan lukien välitön korjaus anemia ja tarkkuus sekä sikiön hydrops, alennettua hemolyysi ja myöhemmin hyperinsulinemia, ja kiihtyvyys sikiön kasvun nonhydropic sikiöt, jotka ovat usein kasvun jälkeenjäänyt. IVT on ainoa moribundin vesisikiöille ja niille, joilla on anteriorinen istukka. Sikiön menetyksen riski on noin 0,8% IVT: llä ja 3: lla.,5% / menettely IPT, ja kokonaiselinaika on 88%.
Äskettäin pesty äidin RBCs on onnistuneesti käytetty lähteenä antigeeni-negatiivinen RBCs, jos harvinainen yhteensopimattomuus, mutta myös on ollut rutiininomaisesti käytetty, koska etuja, kuten vähentynyt riski herkistyminen uusien punasolujen antigeenejä, pidempi kiertävä puoliintumisaika on tuore, ja vähentynyt riski siirto-virus-aineita. Äiti voi lahjoittaa punasoluyksikön ensimmäisen raskauskolmanneksen jälkeen.,
mikäli keuhkojen kypsymättömyyttä ja delta-OD 450 vaikuttaa alueen Queenan käyrä, suun kautta 30 mg fenobarbitaalia äiti 3 kertaa päivässä, jota seuraa induktio yhden viikon aikana, vähentää tarvetta verenvaihdolla sairaaseen vastasyntyneeseen. Erinomainen algoritmeja hallintaan ensimmäinen vaikuttaa raskauden ja raskauden äiti aiemmin vaikuttaa sikiöön ovat esitetty arvostelu yrityksestä Moise (ks. kuvat alla).
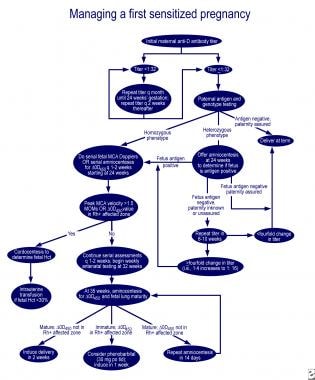 Hallinta ensin vaikuttaa raskauden.,
Hallinta ensin vaikuttaa raskauden., 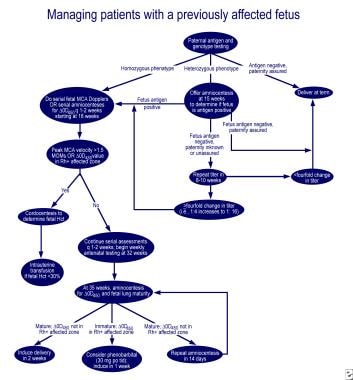 Hallinta raskaana olevat naiset, joilla on aiemmin vaikuttaa sikiöön.
Hallinta raskaana olevat naiset, joilla on aiemmin vaikuttaa sikiöön. ensimmäiset yritykset tukahduttaa Rh-vasta-aineiden tuotantoa Rh hapteenia, Rh-positiivinen RBC strooman, ja hallinnon promethazine olivat tuloksettomia. Laaja plasmafereesi-osittainen korvaaminen käyttäen 5% albumiini (terapeuttinen plasma-exchange) ja laskimonsisäinen immunoglobuliini (IVIG) tai hallinnon IVIG-1 g/kg kehon painoa viikossa on osoitettu olevan kohtalaisen tehokkaita., Vaikutusmekanismi näyttää olevan tukos Fc-reseptoreihin istukan, vähentää vasta-liikenne poikki sikiölle, Fc reseptoreihin fagosyyttien sikiön retikuloendoteliaalijärjestelmän, ja palaute esto äidin vasta-aineiden synteesin. Kuitenkin, vasta-aine riippuvaisen soluvälitteisen sytotoksisuuden ja rebound korkeus vasta-aineiden pitoisuus, muuttaminen istukan verenkiertoa menettelyn aikana, ja synnytyksen verenvuoto on havaittu sen jälkeen, kun veriplasman vaihto.,
uudempi retrospektiivinen tutkimus, joka käsittää 5 raskaana oleville naisille, joilla on vaikea HDFN, koska RBC alloimmunization todettu, onnistunut hoito, jossa on yhdistetty hoito terapeuttinen plasman vaihto, IVIG, ja kohdunsisäinen verensiirto (IUT) varhain raskauksia. Naiset tehtiin 3 plasman vaihto menettelyjä aikana viikkojen 10-13 aikana, seuraavat viikoittain IVIG-uutteet; sikiöistä sai RBC yksikköä, joka on täysin sovitettu äidin fenotyyppi D, C, E, K, Fy, Jk ja S-antigeeni ryhmiä. Kaikki naiset synnyttivät terveitä vauvoja 33-38 viikon raskausviikolla.,
Kuitenkin, nämä tekniikat vain lykätä tarvetta perkutaaninen navan veren näytteenotto (PUBEJA) ja ammatillisen PERUSKOULUTUKSEN, kunnes 20-22 raskausviikolla, kun nämä menettelyt voidaan suorittaa enemmän hyväksyttävä riski. IVIG: n käytön tarkastelu osoittaa sen hyödyllisyyden sikiönhydroksien puhkeamisen estämisessä ja IUT: n tarpeen viivästyttämisessä., Näin ollen yhdistetty lähestymistapa plasmafereesi, joka alkaa klo 12 raskausviikolla 3 kertaa joka viikko, jonka jälkeen IVIG klo aloitusannoksella 2 g/kg sen jälkeen, kun kolmas plasmafereesi, ja sitten jatkoi IVIG-1 g/kg/vko, kunnes 20 raskausviikolla on esitetty at-risk-sikiöiden ennen 20 raskausviikolla ja voi myös käyttää myöhemmin raskauden, jos ammatillisen PERUSKOULUTUKSEN ei voida suorittaa tai jos hydrops on penseä PERUSKOULUTUKSEN.,
Yksi raportti osoitti, että hoito sikiöistä, joilla on vaikea alloimmunization käyttäen ammatillisen PERUSKOULUTUKSEN yhdistää sikiön IVIG-hoitoa annoksella 1 g/kg/annos alkaen kolmannella IVT auttoi vähentämään taajuus ammatillisen PERUSKOULUTUKSEN ja parantaa merkkejä hydrops. Case-raportti osoittaa, onnistunut hoito vaikea anemia ja hydrops on sikiön alloimmunization koska anti-M vasta-aine sikiön vatsaonteloon IVIG-injektiot 2 g/kg annettuna viikoittain alkaen 30 viikkoa. Kyseessä oli kuitenkin tapausraportti, ja satunnaistettu kontrolloitu oikeudenkäynti tarvitaan, ennen kuin siitä voi tulla hoidon standardi.,
Samanlainen hoito, tutkimukset ja hoidon hallinnassa käytetään raskauksista vaikuttaa nonRhD alloimmunization, kuten anti-Rhc, anti-K (K1), ja anti-M. Kerran äiti on diagnosoitu vasta-aine liittyy hemolyyttinen tauti, epäsuora Coombsin titteri on suoritettu, yhdessä isän testaus mukana antigeenin ja zygosity. Äidin tiitterit ovat toistuvia (kuukausittain, kunnes 28 raskausviikolla ja sitten joka 2. vko), kunnes kynnys sikiön anemia on saavutettu (1:8 Kell ja 1:32 lepoa).,
Sikiön antigeeni kirjoittaminen on suoritettu kautta lapsivesipunktio tai solu-ilmainen sikiön DNA äidin plasmassa, jos isä tulee olla heterotsygoottinen (100% K1, 65% M). Kun sikiö on tunnetusti antigeeni positiivinen, valvonta vakavia sikiön anemia on suoritettu, viikoittain MCA Doppler seulonta jo 16-18 viikkoa, ja IUT suoritetaan, jos se on yli 1,5 ÄITI ja toimitus 38 raskausviikolla.
Äidin alloantibodies että isän valkosoluja on osoitettu johtavan Fc saarto ja vähentää vakavuus sikiön hemolyyttinen anemia., Tätä voidaan käyttää tulevaisuudessa.
Hallinta herkistynyt vastasyntyneeseen
Lievä hemolyyttinen taudin osuus on 50% vastasyntyneistä, joilla on positiivinen suora vasta-testin tulokset. Useimmat näistä vastasyntyneet eivät ole aneeminen (johto hemoglobiini >14 g/dL) ja on minimaalinen hemolyysi (johto bilirubiini < 4 mg/dL). Varhaisen valohoidon lisäksi ne eivät vaadi verensiirtoja. Nämä vastasyntyneet ovat kuitenkin vaarassa sairastua vaikeaan myöhäiseen anemiaan 3-6 viikon elinajalla. Siksi niiden Hb-tason seuranta sairaalapurkauksen jälkeen on tärkeää.,
keskivaikea hemolyyttinen sairaus aiheuttaa noin 25% sairastuneista vastasyntyneistä. Kohtalainen hemolyyttinen sairaus vastasyntyneen on ominaista kohtalainen anemia ja lisääntynyt johto bilirubiini tasot. Nämä lapset eivät ole kliinisesti kateellinen syntyessään, mutta nopeasti kehittää konjugoitumattoman hyperbilirubinemia ensimmäisen 24 tunnin elämän. Reuna-kokeena näyttää lukuisia tumallisiin Punasoluihin, vähentynyt määrä verihiutaleita, ja, joskus, suuri määrä epäkypsä granulosyyttien., Näillä vastasyntyneillä on usein hepatosplenomegalia ja heillä on riski sairastua bilirubiiniseen enkefalopatiaan ilman asianmukaista hoitoa. Varhainen vaihto verensiirto tyypin O Rh-negatiivisten tuoreiden RBCs: ien kanssa intensiivisellä valohoidolla on yleensä tarpeen. Käyttö IVIG-annoksina 0,5-1 g/kg yhden tai useita annostus ovat voineet tehokkaasti vähentää tarvetta verenvaihdolla.,
mahdollisille satunnaistetussa kontrolloidussa tutkimuksessa on osoitettu alussa korkea-annos IVIG-1 g/kg 12 tunnin iässä vähentää kesto valohoitoa ja sairaalassa ja estää verenvaihdolla vastasyntyneillä, joilla oli kohtalaisesti tai Rh isoimmunization. Nämä vastasyntyneet ovat myös vaarassa sairastua myöhäiseen hyporegeneratiiviseen anemiaan vauvaiässä 4-6 viikon iässä. Eräässä satunnaistetussa lumekontrolloidussa kaksoissokkotutkimuksessa ei kuitenkaan voitu osoittaa profylaktisen IVIG-hoidon hyötyä 0.,75 g/kg 4 tunnin sisällä ikä vakavasti vaikuttaa vastasyntyneillä, jotka hoidettiin kohdunsisäisen verensiirron Rh isoimmunization.
Vakava hemolyyttinen sairaus, osuus loput 25% alloimmunized vastasyntyneet, jotka ovat joko kuolleena tai hydropic syntyessään. Sikiön hydrops on pääasiassa aiheuttanut hiussuonivuoto-oireyhtymä johtuu kudoksen hypoksia, hypoalbuminemia toissijainen maksan toimintahäiriö, ja korkea-tuotos-sydämen vajaatoiminta anemia., Noin puolet näistä sikiöistä tullut hydropic ennen 34 raskausviikolla ja tarvitsevat tehostettua seurantaa ja hallintaa alloimmunized tiineyden kuten aiemmin on kuvattu. Lievä hydrops, joihin liittyy askites kääntää kanssa IVTs vain 88% tapauksissa parantaa selviytymistä, mutta vaikea hydrops aiheuttaa päänahan turvotus ja vaikea askites ja keuhkopussin nestepurkaumia kääntää 39% tapauksista ja ovat yhteydessä huonoon selviytymiseen.
Hallinta ABO yhteensopimattomuus
Management of hyperbilirubinemia on suuri huolenaihe vastasyntyneillä ABO yhteensopimattomuus., Verensiirron ja valohoidon kriteerit ovat samanlaiset kuin Rh alloimmunizationissa. IVIG on myös ollut erittäin tehokas annettaessa aikaisin kurssin. Tina (Sn) porfyriinin voimakas estäjä hemioksigenaasi, entsyymi, joka katalysoi nopeutta rajoittava vaihe tuotannossa bilirubiini hemi, on osoitettu vähentävän tuotantoa bilirubiini ja vähentää tarvetta verenvaihdolla ja kesto valohoitoa vastasyntyneillä ABO yhteensopimattomuus.
tina-tai sinkkiprotoporfyriinia tai mesoporfyriineja on tutkittu vastasyntyneillä., Ne on lihakseen annos perustuu kehon paino, ja niiden tehokkuus näyttää olevan annoksesta kaikissa gestations. Niiden mahdollisia toksisia vaikutuksia ovat ihon valoherkkyys, raudanpuute ja mahdollinen hiilimonoksidin tuotannon estäminen. Niiden käyttöä vastasyntyneen hemolyyttisessä sairaudessa ei ole raportoitu. Niiden rutiinikäyttöä ei voida vielä suositella pitkäaikaisturvallisuustietojen puuttumisen vuoksi.
















Vastaa