piense en lo que sucede a mitad del cambio de color. En este punto las concentraciones del ácido y su ion son iguales. En ese caso, se cancelarán fuera de la expresión amable.
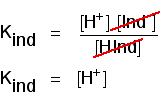
puede usar esto para averiguar cuál es el pH en este punto intermedio., Si reorganiza la última ecuación para que la concentración de iones de hidrógeno esté en el lado izquierdo, y luego convierte a pH y pKind, obtiene:
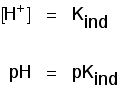
eso significa que el punto final para el indicador depende completamente de cuál es su valor pKind. Para los indicadores que hemos visto anteriormente, estos son:
| indicador | pKind |
|---|---|
| fuego | 6.5 |
| naranja de metilo | 3.7 |
| fenolftaleína | 9.,3 |
el rango de pH de los indicadores
Los indicadores no cambian de color bruscamente a un pH en particular (dado por su pKind). En cambio, cambian en un rango estrecho de pH.
asume que el equilibrio está firmemente a un lado, pero ahora agrega algo para comenzar a cambiarlo. A medida que el equilibrio cambia, comenzarás a obtener más y más del segundo color formado, y en algún momento el ojo comenzará a detectarlo.
por ejemplo, supongamos que tuvieras metil orange en una solución alcalina de modo que el color dominante fuera amarillo., Ahora comience a agregar ácido para que el equilibrio comience a cambiar.
en algún momento habrá suficiente de la forma roja de la naranja de metilo presente que la solución comenzará a tomar un tinte naranja. A medida que vayas añadiendo más ácido, el rojo eventualmente se volverá tan dominante que no podrás ver ningún amarillo.
hay un cambio suave gradual de un color al otro, que tiene lugar en un rango de pH. como una «regla general» aproximada, el cambio visible tiene lugar aproximadamente 1 unidad de pH a cada lado del valor pKind.,
los valores exactos de los tres indicadores que hemos visto son:
| indicator | pKind | pH range |
|---|---|---|
| litmus | 6.5 | 5 – 8 |
| methyl orange | 3.7 | 3.1 – 4.4 |
| fenolftaleína | 9.3 | 8.3 – 10.0 |
el cambio de color de tornasol ocurre en un rango inusualmente amplio, pero es útil para detectar ácidos y álcalis en el laboratorio porque cambia de color alrededor de pH 7., La naranja de metilo o la fenolftaleína serían menos útiles.
esto se ve más fácilmente diagramáticamente.
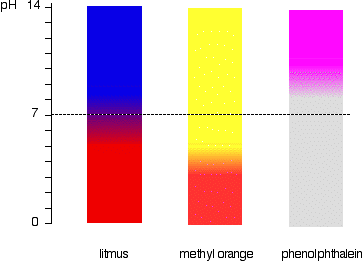
por ejemplo, methyl orange sería amarillo en cualquier solución con un pH mayor que 4.4. No podía distinguir entre un ácido débil con un pH de 5 o un álcali fuerte, con un pH de 14.
elegir indicadores para titulaciones
recuerde que el punto de equivalencia de una titulación es donde se han mezclado las dos sustancias en proporciones exactamente ecuación., Obviamente, debe elegir un indicador que cambie de color lo más cerca posible de ese punto de equivalencia. Esto varía de una titulación a otra.
ácido fuerte v base fuerte
el siguiente diagrama muestra la curva de pH para agregar un ácido fuerte a una base fuerte. Sobre él se superponen los rangos de pH de la naranja de metilo y la fenolftaleína.
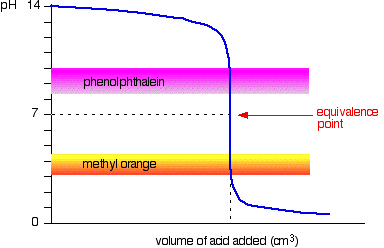
Usted puede ver que ni el indicador cambia de color en el punto de equivalencia.,
sin embargo, el gráfico es tan empinado en ese punto que prácticamente no habrá diferencia en el volumen de ácido agregado, sea cual sea el indicador que elija. Sin embargo, tendría sentido valorar al mejor color posible con cada indicador.
si usa fenolftaleína, valorará hasta que se vuelva incolora (a pH 8.3) porque eso es lo más cerca que puede llegar al punto de equivalencia.
por otro lado, usando methyl orange, se titularía hasta que haya el primer rastro de naranja en la solución., Si la solución se vuelve roja, se está alejando del punto de equivalencia.
ácido Fuerte v base débil
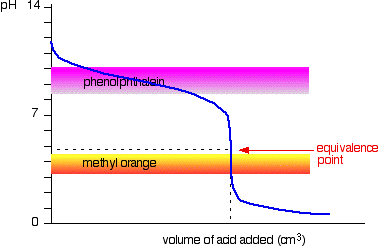
Esta vez es obvio que fenolftaleína sería completamente inútil. Sin embargo, el naranja de metilo comienza a cambiar de amarillo hacia naranja muy cerca del punto de equivalencia.
Usted tiene que elegir un indicador que cambia de color en la parte más empinada de la curva.
ácido Débil v base fuerte
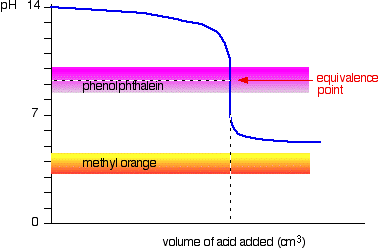
Esta vez, el naranja de metilo es desesperante!, Sin embargo, la fenolftaleína cambia de color exactamente donde usted lo desea.
ácido débil v base débil
la curva es para un caso donde el ácido y la base son igualmente débiles, por ejemplo, ácido etanoico y solución de amoníaco. En otros casos, el punto de equivalencia será en algún otro pH.
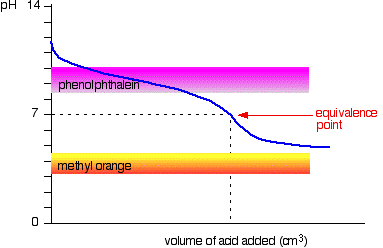
Usted puede ver que ni el indicador es cualquier uso. La fenolftaleína habrá terminado de cambiar mucho antes del punto de equivalencia, y la naranja de metilo se cae del gráfico por completo.,
Puede ser posible encontrar un indicador que comienza a cambiar o termina de cambiar en el punto de equivalencia, pero debido a que el pH del punto de equivalencia será diferente de un caso a otro, no se puede generalizar.
Sobre todo, nunca se valora un ácido débil y una base débil en presencia de un indicador.
solución de carbonato de sodio y ácido clorhídrico diluido
Este es un caso especial interesante., Si utiliza fenolftaleína o naranja de metilo, ambos darán un resultado válido de valoración, pero el valor con fenolftaleína será exactamente la mitad del de naranja de metilo.
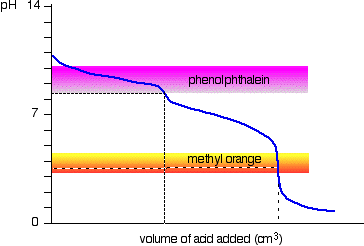
sucede que la fenolftaleína ha terminado su cambio de color exactamente al pH del punto de equivalencia de la primera mitad de la reacción en la que se produce hidrogenocarbonato de sodio.
![]()
![]()
El naranja de metilo cambios de color en exactamente el pH del punto de equivalencia de la segunda etapa de la reacción.,
![]()
![]()
Preguntas para comprobar su comprensión
Si este es el primer conjunto de preguntas que usted ha hecho, por favor, lea la página de introducción antes de empezar. Usted tendrá que utilizar el botón Atrás en su navegador para volver aquí después.
preguntas sobre los indicadores
respuestas
¿Dónde te gustaría ir ahora?
al menú equilibrio ácido-base . . .
al menú de Química Física . . .
Al Menú Principal . . .,
















Deja una respuesta