Introduction
los cloroplastos representan una característica estructural de las células vegetales y apoyan la supervivencia de las plantas a través de su metabolismo primario y funciones de alto nivel (Kirk y Tilney-Bassett, 1978; Mullet, 1988; López-Juez y Pyke, 2005). Durante el crecimiento vegetativo de la planta, las células foliares contienen una población altamente homogénea de cloroplastos en cuanto a tamaño y forma., El número de cloroplastos por célula se logra mediante la fisión binaria de orgánulos preexistentes y la partición en dos células hijas durante la división celular (Birky, 1983; Possingham y Lawrence, 1983). Por lo tanto, la regulación del número de cloroplastos en un tipo celular dado es crucial para la función celular y la herencia genética de los cloroplastos.
para investigar la naturaleza de la determinación del número de cloroplastos en células vegetales, las células mesófilas de las hojas de especies representativas han jugado un papel importante ., Estas células son fisiológicamente importantes para la fotosíntesis y muestran un alto grado de homogeneidad estructural y funcional. Análisis de observación sistemática temprana de tejidos y células aislados (Boasson y laetsch, 1969; Possingham y Saurer, 1969; boffey et al., 1979; Lamppa et al.,, 1980; Thomas y Rose, 1983; Pyke y Leech, 1991) proporcionaron mucha información útil sobre la determinación del número de cloroplastos, incluida la noción de que los cloroplastos (plastidos) no se sintetizan de novo sino que se replican por división y la observación de que el número de cloroplastos mesofílicos de las hojas es sensible a diversos factores ambientales y endógenos de las plantas. Con respecto a esto último, en las espinacas, la luz tiene un impacto positivo en la división de cloroplastos durante el cultivo del disco foliar en comparación con condiciones tenues u oscuras (Possingham y Lawrence, 1983)., En las primeras hojas del trigo, el volumen celular se correlaciona positivamente con la proliferación de cloroplastos (Ellis y Leech, 1985; Pyke y Leech, 1987). En Arabidopsis, el fondo genético afecta la proliferación de cloroplastos; el número promedio de cloroplastos por célula en las primeras hojas es 121 en el ecotipo Landsberg erecta (Ler) y 83 en el ecotipo Wassilewskija (Ws) (Pyke y Leech, 1994; Pyke et al., 1994)., Las células mesofílicas de la hoja también han contribuido a comprender el control genético de la división de cloroplastos; por ejemplo, el cribado de mutantes deteriorados en la proliferación de cloroplastos y la caracterización de las funciones génicas involucradas en la división de cloroplastos han revelado más de 20 genes que codifican componentes de maquinaria de la división de cloroplastos o factores reguladores de cloroplastos (Gao y Gao, 2011; Miyagishima et al., 2011; Basak y Møller, 2013; Osteryoung y Pyke, 2014; Li et al., 2017).
por el contrario, los estudios sobre la replicación de cloroplastos en células no mesófilas (P.,, pavement cells in leaf epidermis; Itoh et al., 2018) son escasos. Recientemente, se ha informado que la regulación de la división de cloroplastos difiere entre los tejidos foliares (Fujiwara et al., 2018; Itoh et al., 2018), Aunque el mecanismo detallado sigue siendo desconocido. Además, mientras que los análisis de células en suspensión cultivadas por-2 y protoplastos mesófilos foliares en meristemo apical de tabaco y brotes y células primordiales foliares en Arabidopsis (Nebenführ et al., 2000; Sheahan et al.,, 2004; Seguí-Simarro y Staehelin, 2009) han proporcionado información importante, todavía no está claro cómo se regula la partición de cloroplastos (plastidos) en las plantas. Por lo tanto, a pesar de un esfuerzo considerable, quedan cuestiones fundamentales en la investigación de cloroplastos, como (I) cómo se coordina el número de cloroplastos por célula en los tejidos vegetales y (ii) cómo se regula la partición de cloroplastos en la división celular.,
History of Research on Guard Cell Chloroplast Number
Stomatal GCs in the shoot epidermis generally contain chloroplasts and control gas exchange between the leaf mesophyll and the atmosphere (Sachs, 1875; Taiz et al., 2015; Véase la figura 1A). La primera investigación del número de cloroplastos GC en hojas se realizó hace más de un siglo en plantas de Drosera cultivadas naturalmente (Macfarlane, 1898)., Este estudio demostró que, al igual que otras características estructurales de plantas y células, el número de cloroplastos GC por célula en un supuesto híbrido derivado de un cruce entre Drosera filiformis y Drosera intermedia era intermedio entre las dos especies, lo que implica que el número de cloroplastos GC podría usarse para determinar la composición genética de una planta. Posteriormente se reportaron importantes observaciones sobre las diferencias en el número de cloroplastos de CG entre especies de plantas (Sakisaka, 1929) y el número relativamente estable de cloroplastos en GCs en la epidermis foliar de morera (Morus spp.,; Hamada y Baba, 1930) y en hojas maduras de varias especies de Brassica (Iura, 1934). Además, el análisis de plantas de remolacha azucarera autopoliploide (Beta vulgaris) reveló que el número de cloroplastos GC en las hojas se correlaciona positivamente con el nivel de ploidía nuclear de las plantas (Mochizuki y Sueoka, 1955). Posteriormente se realizaron análisis más exhaustivos y exhaustivos utilizando diversas muestras de plantas para investigar la relación entre el número de cloroplastos y el tamaño estomático y el nivel de ploidía (por ejemplo, Frandsen, 1968)., En estos análisis, el conteo de cloroplastos a nivel estomático (par GC) se adoptó con frecuencia, lo que excluyó el efecto de la distribución sesgada de cloroplastos entre GCs pares (por ejemplo, Mochizuki y Sueoka, 1955; Frandsen, 1968), revelando que el número promedio de cloroplastos GC en hojas o cotiledones en aproximadamente 80 especies, variantes o híbridos varió de 2.8 a 40.0 en diploides (2×) y de 5.0 a 73.5 en tetraploides (4×). Además, los eventos de duplicación del genoma completo en las plantas(es decir, 1× a 2×, 2× a 4×, etc.) causó aproximadamente 1.,7-fold increase in GC chloroplast number with high fidelity (reviewed in Butterfass, 1973). Estos resultados alentaron las investigaciones sobre el nivel de ploidía en varios tejidos y plantas obtenidas mediante Cultivo de tejidos, cruce o cultivo natural, en combinación con tratamientos químicos (por ejemplo, colchicina) o radioterapia (por ejemplo, Jacobs y Yoder, 1989; Singsit y Veilleux, 1991; Qin y Rotino, 1995)., Si bien el número de cloroplastos GC se ha estudiado en Biología estomatal (Lawson, 2009) y citología para comprender la multiplicación de cloroplastos (Butterfass, 1979; véase más adelante), ha servido en gran medida como un marcador confiable y conveniente para la detección de híbridos, especies y variantes y para la estimación de los niveles de ploidía de los tejidos de las plantas Diana.
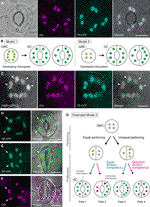
Figura 1 modelos simplificados y evidencia microscópica para el control del número de cloroplastos en células de guardia estomatal (GCs)., A) un estoma típico (par GC) en la epidermis abaxial de la hoja de Arabidopsis que expresa una fusión dirigida al estoma del péptido de tránsito (TP) con la proteína fluorescente cian (CFP; TP-CFP). B) dos modelos de determinación del número de cloroplastos en CCG, que incluyen la partición de cloroplastos (modelo 1) o la proliferación y partición de cloroplastos (modelo 2) durante el desarrollo de CG a partir de células madre guardianes (CCG). (C) Un par de GC en epidermis adaxial de pecíolo de hoja de Arabidopsis que expresa TP-CFP y FtsZ1 fusionados a la proteína verde fluorescente (GFP; FtsZ1-GFP)., (D–F) pares de GC en epidermis abaxial de hoja de Arabidopsis con (D, E) o sin (F) la expresión de TP fusionado a la proteína fluorescente amarilla (yfp; TP-YFP). F) La autofluorescencia de Clorofila (Chl) se utilizó como marcador de cloroplastos., G) Modelo ampliado 2, que representa la participación de la división igual y desigual de cloroplastos después de la división GMC y la división posterior de cloroplastos GC con competencia de división igual (línea azul) o selectiva (línea roja), lo que daría lugar a cuatro tipos de determinación del número de cloroplastos (destinos 1 a 4) durante el desarrollo estomático tardío de las hojas de Arabidopsis. (A, C–F) la microscopía de Epifluorescencia se realizó con un microscopio invertido Olympus IX71 utilizando materiales vegetales como se describió anteriormente (Fujiwara et al., 2017, Fujiwara et al., 2018)., Las señales de fluorescencia de clorofila, CFP, GFP e YFP son pseudo-coloreadas en magenta, Cian, Verde (solo en la imagen fusionada) y verde, respectivamente. Las indicaciones en los paneles son las siguientes: punta de flecha, el anillo FtsZ1; flecha, cloroplasto GC ampliado; línea discontinua, forma de celda. Barra de escala = 10 µm.
utilidad de las células de protección foliar para el análisis del Control del número de cloroplastos
las células mesófilas foliares han sido empleadas durante mucho tiempo como modelo primario para el análisis del número de cloroplastos., Si bien tienen ventajas para el estudio de los efectos de las condiciones ambientales en la división de cloroplastos (por ejemplo, la señalización de luz-citoquinina; Boasson y laetsch, 1969; Possingham y Lawrence, 1983; Okazaki et al., 2009; Chiang et al., 2012), son limitados en algunos aspectos. En primer lugar, las células mesófilas de las hojas varían en tamaño y forma y se distribuyen profundamente dentro de la hoja, lo que dificulta la manipulación de los tejidos intactos., En segundo lugar, la susceptibilidad de la proliferación de cloroplastos mesofílicos de las hojas al estrés ambiental y a las condiciones de crecimiento de las plantas puede impedir comparaciones confiables entre estudios. El número de cloroplastos mesofílicos de la hoja por célula en el ecotipo de Arabidopsis Columbia (Col) se ha reportado de diversas maneras como 76 (Kinsman y Pyke, 1998), 80-100 (Stokes et al., 2000), 70 (Tirlapur y König, 2001), 41 (Yoder et al., 2007), 40-60 (Okazaki et al., 2009), y 30-40 (Kawade et al., 2013)., Además, es casi imposible evaluar la contribución de la partición de cloroplastos al número final de cloroplastos por célula mesófila durante el desarrollo de la hoja, aunque se cree que esto está determinado por el equilibrio entre la tasa de división celular y la tasa de división de cloroplastos. Para descubrir el mecanismo de control del número de cloroplastos en células de hojas vegetativas, se requiere un sistema modelo que supere los problemas anteriores.
Los GCs Estomatales (ver figura 1a) presentan las características de un sistema modelo para comprender el mecanismo de control del número de cloroplastos., Los GCs son altamente uniformes en tamaño y forma dentro de un tejido, y su distribución dispersa pero densa en la capa más externa de brotes facilita su detección por microscopía de luz y fluorescencia. Los GCs también se derivan de células protodérmicas en el meristemo apical del brote o de células epidérmicas embrionarias, y su secuencia de desarrollo a través de meristemoides (un precursor estomático con actividad meristemática) y células madre guardianes (GMCs; un precursor de pares de GC) se establece en detalle (Zhao y Sack, 1999; Nadeau y Sack, 2002; Kalve et al., 2014)., El desarrollo estomático tardío implica una sola ronda de división GMC simétrica, que permite la evaluación de la distribución y partición de cloroplastos antes y después de la citocinesis. Desde la perspectiva de los experimentos prácticos, los GCs de hoja son adecuados para microscopía. Se demostró previamente que el número de cloroplastos por célula en GCs foliares de Sinapis alba estaba menos afectado por diferentes condiciones de luz que el de las células mesófilas foliares (Wild y Wolf, 1980)., Además, la diferencia en el número de cloroplastos GC en los pecíolos de las hojas es relativamente menor entre los tres ecotipos de Arabidopsis Col, Ler y Ws (Fujiwara et al., 2018). Además, no se ha detectado endoreduplicación, que afecta el desarrollo de mesófilas foliares, pavimentos y células tricómicas, en las GCs foliares de Arabidopsis (Melaragno et al., 1993), lo que aseguraría las interpretaciones de los datos del número de cloroplastos en el nivel 2C de las células., En conjunto, estos informes sugieren que los GCs de la hoja son potencialmente un modelo excelente para el análisis sistemático de la dinámica del número de cloroplastos en un linaje celular particular.
Arabidopsis Leaf Guard Cells as a Model for Studying the Control of Chloroplast Number
en la historia de la investigación de cloroplastos GC, el conteo de cloroplastos a nivel estomático (par GC) ha desempeñado un papel igualmente importante en la determinación del número de cloroplastos como el conteo a nivel de GC individual. Ambos métodos producen el mismo número medio de cloroplastos (Butterfass, 1973)., Cuando la variación en la distribución de cloroplastos en GCs pareados y su mecanismo subyacente es un tema de enfoque, la información detallada de los cloroplastos a nivel celular individual, es decir, su tamaño, forma y localización intracelular, es esencial. La proliferación de cloroplastos (plastidos) durante la diferenciación GMC–GC se investigó previamente en varias especies de plantas (Butterfass, 1973, Butterfass 1979)., Estos estudios propusieron dos modelos para determinar el número terminal de cloroplastos en GCs en diferentes especies de plantas( figura 1B): uno (modelo 1; remolacha azucarera) involucra solo la partición de cloroplastos en la división GMC, y el otro involucra no solo la partición de cloroplastos sino también la proliferación de cloroplastos durante el desarrollo de GC.
en la era de la Genética molecular, la genómica, la imagen celular y otros análisis interdisciplinarios, hay muchas posibilidades para la caracterización adicional del mecanismo de partición de cloroplastos., Arabidopsis leaf GCS puede ser uno de los mejores sistemas modelo para este propósito. Varios estudios han examinado el número de cloroplastos GC en las hojas o cotiledones de Arabidopsis (Hoffmann, 1968; Pyke y Leech, 1994; Pyke et al., 1994; Robertson et al., 1995; Keech et al., 2007; Chen et al., 2009; Yu et al., 2009; Higaki et al., 2012; Fujiwara et al., 2018). Estos GCs exhiben un número modesto de cloroplastos, que van de 3,5 a 5,5 en promedio. Hasta la fecha, ningún estudio ha examinado las alteraciones en el número de cloroplastos (plastidos) durante el desarrollo estomático., Sin embargo, la evidencia microscópica de los análisis del desarrollo estomático (por ejemplo, Zhao y Sack, 1999; Hachez et al., 2011) y nuestras observaciones preliminares indican que los GMCs pueden contener un menor número de cloroplastos en desarrollo que los GCs y que la proliferación de cloroplastos puede ocurrir durante la diferenciación de GC. Para probar esto, se monitoreó la formación de la maquinaria de la división de cloroplastos en GCs con la sonda ftsz1 fusionada a la proteína fluorescente verde (Ftsz1-GFP) (Fujiwara et al., 2008)., Una línea transgénica, que expresaba simultáneamente un péptido de tránsito (TP) fusionado CFP y FtsZ1-GFP para visualizar el estroma y el anillo FtsZ1, respectivamente, fue examinada por microscopía de epifluorescencia (Fujiwara et al., 2017). Se emplearon pecíolos de hojas en expansión (quinta hoja de plántulas de 4 semanas de edad). Como resultado, se detectaron GCs con cloroplastos constrictores simétricos (figura 1C). Estos cloroplastos formaron el anillo FtsZ1, un anillo de división de cloroplastos en la superficie estromal de la membrana de la envoltura interna en el mesófilo de la hoja y las células del pavimento (Vitha et al., 2001; Fujiwara et al.,, 2008), en el sitio de constricción Ecuatorial. Consistente con el patrón estomático en el desarrollo de la hoja de Arabidopsis (Donnelly et al., 1999; Andriankaja et al., 2012), se detectaron cloroplastos divisores en la etapa tardía y temprana de la expansión foliar. Por lo tanto, el modelo 2 es probablemente el mejor ajuste para la hoja de Arabidopsis GCs.
relación entre proliferación y expansión de cloroplastos en células protectoras foliares de Arabidopsis
Además, se observó un fenotipo inesperado de morfogénesis de cloroplastos CG en GCs Maduras (Figuras 1D, E)., Cuando se caracterizaron microscópicamente las exfoliaciones epidérmicas de hojas completamente expandidas (tercera–cuarta hoja de plántulas de 4 semanas de edad) de una línea de proteína fluorescente amarilla fusionada con TP (yfp) (línea FL6-5; Fujiwara et al., 2018), algunos estomas mostraron patrones de distribución de cloroplastos desiguales en pares de CG, mientras que la mayoría de los estomas foliares mostraron patrones de distribución de cloroplastos iguales o similares (Robertson et al., 1995; Fujiwara et al., 2018)., Dentro del par GC de un estoma, el tamaño de los cloroplastos en el GC que contenía un número menor de cloroplastos era mayor que en los otros GCs en el par que contenía un número mayor de cloroplastos (Figuras 1D, E). De esta manera, los GCs probablemente mantienen el volumen total de cloroplastos por célula a un nivel constante durante el crecimiento celular. Los cloroplastos agrandados representaban el fenotipo terminal y ya no podían dividirse en hojas expandidas. Estos resultados se confirmaron en varios experimentos independientes, independientemente de la expresión de una proteína fluorescente fusionada con TP para el etiquetado de estroma (figura 1F).,
este fenotipo de cloroplasto GC se interpreta como un mecanismo de compensación para la expansión de cloroplastos, que estaba bien documentado en células mesofílicas foliares defectuosas en el control de la división de cloroplastos (Pyke y Leech, 1994; Pyke et al., 1994). Hasta la fecha, solo un estudio (Ellis y Leech, 1985) ha reportado una correlación negativa entre el número de cloroplastos y el tamaño de los cloroplastos en las células del mesófilo de la hoja de trigo, mientras que muchos estudios han reportado una correlación positiva entre el volumen celular y el número de cloroplastos en las células normales del mesófilo de la hoja (Leech y Pyke, 1988; Pyke, 1997)., Mientras que los desequilibrios en el número de cloroplastos CG ocurren a baja frecuencia (Fujiwara et al., 2018), la heterogeneidad de cloroplastos en pares de CG indica que la partición desigual de cloroplastos podría desencadenar el crecimiento diferencial de cloroplastos entre células de hojas silvestres en Arabidopsis, a pesar de la división celular simétrica.
el efecto de compensación de cloroplastos en GCs puede ser menos estricto que en las células mesofílicas de la hoja., Las GCs podrían ser capaces de soportar la escasez o la pérdida completa del volumen total de cloroplastos por célula en mutantes de la división de cloroplastos gravemente deteriorados, como en Arabidopsis arc6 y atminE1 y suffulta de tomate, mientras que muchas GCS mutantes mostraron un número reducido de cloroplastos y un tamaño de cloroplastos aumentado de manera similar a las células mesofílicas de la hoja (Robertson et al., 1995; Forth y Pyke, 2006; Chen et al., 2009; Fujiwara et al., 2018)., En un mutante tardío de la división de cloroplastos, arc5, la reducción en el número de cloroplastos GC no se asoció con un aumento significativo en el tamaño de los cloroplastos, a diferencia de las células mesófilas de las hojas (Pyke y Leech, 1994). Un menor grado de expansión de cloroplastos en GCs que en células mesofílicas (Pyke y Leech, 1994; Barton et al., 2016), y la variación en la expansión de cloroplastos entre GCs, podría ser la base de un rango tan amplio permisible de volumen total de cloroplastos por GC., Además, el momento de la división de cloroplastos durante la diferenciación GMC-GC podría afectar significativamente el fenotipo terminal de cloroplastos GC. Aunque se requiere una caracterización más detallada para abordar esta cuestión, parece plausible que los GCs de las hojas de Arabidopsis representen un sistema para investigar los aspectos no explotados del control del número de cloroplastos en células vegetales.,
a Working Model For Chloroplast Number Determination in Arabidopsis Leaf Guard Cells
En base a lo anterior, proponemos un modelo de trabajo (modelo extendido 2) para el análisis del número de cloroplastos en GCs (figura 1g). El número final de cloroplastos por GC se determina por la partición de cloroplastos en la división GMC y la proliferación de cloroplastos en GCs. Durante la división GMC, los cloroplastos pueden sufrir una partición igual o desigual. Durante la proliferación de cloroplastos, los cloroplastos GC proliferarán con competencia de división igual (línea azul) o selectiva (línea magenta)., Por ejemplo, si los cloroplastos igualmente divididos poseen una competencia de división equivalente, se producirán números iguales de cloroplastos en el par GC (destino 1). Si los cloroplastos desigualmente divididos poseen una competencia de división equivalente, los cloroplastos aumentarán a la misma velocidad dentro del par GC (destino 3). Si la división selectiva de cloroplastos ocurre en GCs, el balance del número de cloroplastos en el par GC cambiará después de la división GMC (destinos 2 y 4)., Actualmente es difícil encontrar apoyo para la» división selectiva de cloroplastos», pero si los destinos 1 y 4 realmente predominan en GCs, entonces podrían poseer un mecanismo que controle el volumen total de cloroplastos por célula, como en las células mesófilas de la hoja. El modelo plantea dos cuestiones: (i) ¿se dividen los cloroplastos GC adecuadamente en células hijas y cómo se dividen? And (ii) is division competency of GC chloroplasts coordinately regulated?,
con respecto a la cuestión (i), ya sea que la herencia de cloroplastos ocurra por distribución aleatoria de múltiples cloroplastos en el citoplasma o por un mecanismo positivo de partición de cloroplastos ha sido una preocupación de larga data(Butterfass, 1969; Birky, 1983; Hennis y Birky, 1984; Nebenführ, 2007; Sheahan et al., 2016). Curiosamente, en Arabidopsis arc6, los GCs de hoja o de cotiledón tienen de cero a tres cloroplastos, y en los GCS deficientes en cloroplastos, los plastidos no fotosintéticos todavía existen en formas vesiculares a alargadas (Robertson et al., 1995; Chen et al., 2009; Fujiwara et al., 2018)., No se han encontrado GCs desprovistos de plastidos per se en arc6, y no se ha dado ninguna explicación para esto, a pesar de la interrupción del aparato de división de cloroplastos (Vitha et al., 2003). En consecuencia, será importante examinar la replicación y la morfología de los cloroplastos arc6 en estudios de linaje estomático. La investigación de mutantes de Arabidopsis también puede dar otra pista para este problema., La observación de que el 18% de los GCs de cotiledón en la hoja arrugada (crl) mutante no contienen estructuras plastídicas en el citoplasma, mientras que el 100% de las células mesófilas de la hoja contienen de uno a cuatro cloroplastos agrandados (Asano et al., 2004; Chen et al., 2009), es de gran importancia. CRL es una proteína de la envoltura externa de cloroplastos con una función desconocida. La comprensión de la función de la proteína CRL puede proporcionar información sobre el mecanismo(s) de la partición de cloroplastos., El análisis de la proliferación y partición de cloroplastos en células mesófilas foliares en mutantes de Arco de Arabidopsis y otras líneas transgénicas ha promovido la investigación sobre la proliferación y partición de plastidos no mesófilos. Asimismo, los resultados obtenidos en GCs pueden ser transferibles a otros sistemas celulares.
observación final
el modelo GC abre muchas perspectivas para el desarrollo de la biología de los cloroplastos. Por ejemplo, mientras que se sabe que los sistemas citoesqueléticos regulan la morfología, el movimiento y la partición de los cloroplastos (Sheahan et al.,, 2016; Wada, 2016; Erickson y Schattat, 2018), el papel de cada gen regulador en la proliferación y partición de cloroplastos en plantas ha recibido poca atención. Por otro lado, una vez que sea posible alterar el número o morfología de cloroplastos GC a través de varias estrategias experimentales, se pueden proporcionar nuevos conocimientos sobre el control molecular de la morfogénesis de cloroplastos en células de linaje estomático. Además, junto con los análisis cuantitativos del número de cloroplastos durante el desarrollo estomatal, el modelado matemático puede ofrecer una nueva vía para estas investigaciones., Este artículo presenta el conocimiento actual de cómo se controla el número de cloroplastos de CG y destaca la utilidad potencial de la hoja de Arabidopsis GCS para comprender la proliferación y partición de cloroplastos.
Declaración de disponibilidad de datos
todos los conjuntos de datos de este estudio están incluidos en el artículo / material suplementario.
contribuciones del autor
MF concibió el estudio y escribió el manuscrito. MF y AS llevaron a cabo los experimentos. AS y RI realizaron los análisis. Todos los autores leyeron y aprobaron el manuscrito final.,
financiación
esta labor fue apoyada por el Ministerio de Educación, Cultura, Ciencia y tecnología del Japón en el marco de KAKENHI (subvención no. 19K05831 a MF y 18k06314 a RI).
conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
agradecimientos
los autores agradecen al Dr. Nobuyuki Kanzawa (Sophia University) el asesoramiento sobre el trabajo.
Birky, C. W., Jr. (1983)., La partición de orgánulos citoplásmicos en la división celular. Int. Apo. Cytol. 15, 49-86.
Google Scholar
butter churn, T. (1969). The plastid distribution in mitosis of the closing cell mother cells of haploid swedenklee (Trifolium hybridum L.). Planta 84, 230-234. doi: 10.1007/Bf00388108
PubMed Abstract | CrossRef Full Text / Google Scholar
butter churn, T. (1973). Control de la división plastídica mediante cantidad de ADN nuclear. Protoplasm 76, 167-195. doi: 10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., Número de plastidos y cambios estructurales asociados al cultivo de protoplastos mesófilos del tabaco y regeneración de plantas. Planta 158, 329-338. doi: 10.1007/bf00397335
PubMed Abstract | CrossRef Full Text/Google Scholar
Tirlapur, U. K., König, K. (2001). Lasers del cercano-infrarrojo del femtosegundo como herramienta nueva para la proyección de imagen de alta resolución en tiempo real no invasor del lapso de tiempo de la división del cloroplasto en células vivas de la vaina del paquete de Arabidopsis. Planta 214, 1-10. doi: 10.,1007/S004250100597
PubMed Abstract | CrossRef Full Text/Google Scholar
Wild, A., Wolf, G. (1980). El efecto de diferentes intensidades de luz sobre la frecuencia y el tamaño de los estomas, el tamaño de las células, el número, tamaño y contenido de cloroplastos en el mesófilo y las células de guardia durante la ontogenia de las hojas primarias de Sinapis alba. Z. Pflanzenphysiol. Bd. 97, 325–342. doi: 10.1016/S0044-328x(80)80006-7
CrossRef texto completo / Google Scholar
















Deja una respuesta