manejo de la aloinmunización materna
Como regla general, los títulos de anticuerpos maternos en serie se monitorizan hasta un título crítico de 1: 32, lo que indica que se ha alcanzado un alto riesgo de hidropesía fetal. En este punto, el feto requiere un monitoreo muy intenso para detectar signos de anemia e hidropesía fetal., En la aloinmunización de Kell, la hidropesía puede ocurrir con títulos maternos bajos debido a la eritropoyesis suprimida, y, por lo tanto, un título de 1:8 se ha sugerido como crítico. Por lo tanto, los valores de delta-OD 450 también son poco fiables en la predicción de la gravedad de la enfermedad en la aloinmunización de Kell.
Los títulos maternos no son útiles para predecir la aparición de anemia fetal después de la primera gestación afectada. Se pueden observar grandes diferencias en el título en el mismo paciente entre diferentes laboratorios, y una técnica de gel más nueva produce resultados de título más altos que el método de tubo más antiguo., Por lo tanto, se debe utilizar la metodología de tubo estándar para determinar el título crítico, y un cambio de más de 1 dilución representa un verdadero aumento en el título de anticuerpo materno. Para todos los anticuerpos responsables de la enfermedad hemolítica del recién nacido (HDN), un aumento de 4 veces en cualquier título de anticuerpo se considera típicamente un cambio significativo que requiere evaluación fetal.
Cuando está indicado, la amniocentesis se puede realizar desde las 15 semanas de gestación (raramente necesaria en el primer embarazo afectado antes de las 24 semanas de gestación) para determinar el genotipo fetal y evaluar la gravedad., Las muestras de sangre materna y Paterna deben enviarse al laboratorio de referencia con una muestra de líquido amniótico para eliminar los resultados falsos positivos (del pseudogén materno o del gen Ccde) y los resultados falsos negativos (de un reordenamiento en el locus del gen RHD en el padre).
la determinación del genotipo Rh Fetal en plasma materno se ha convertido en una rutina en muchos países europeos y se ofrece en los Estados Unidos., El ADN libre de células fetales representa el 3% del ADN plasmático materno circulante total, se encuentra a los 38 días de gestación y se deriva de la apoptosis de la capa citotrofoblástica placentaria. La semivida media del ADN fetal circulante es en promedio inferior a 30 minutos, y el plasma materno se somete a filtración y microcentrifugación para eliminar todos los elementos celulares antes de la prueba. Esto elimina los resultados falsos positivos de células fetales injertadas de embarazos anteriores en órganos linfoides maternos.,
El ADN fetal libre de células se somete a reacción en cadena de la polimerasa (PCR) en tiempo real para la presencia de secuencias específicas del gen RHD y se ha encontrado que es preciso en el 99,5% de los casos. El gen SRY (en el feto masculino) y los polimorfismos de ADN en la población general (en el feto femenino) se utilizan como controles internos para confirmar el origen fetal del ADN libre de células. Se compara un panel de 92 polimorfismos de nucleótido único (SNPs) entre la muestra materna de buffy coat y el plasma., Una diferencia de más de 6 SNPs confirma la presencia de ADN fetal y la validez de la prueba en un feto femenino. Los resultados falsos negativos que son más indeseables y consecuentes se deben a fenotipos D parciales o débiles. Se detectan utilizando al menos dos cebadores de exones específicos de RHD y se ejecutan en duplicados.
afortunadamente, las pruebas de ADN fetal libre de células para determinar el genotipo de otros antígenos de glóbulos rojos como c,C, E, E y Kell también se encuentran ahora para ser altamente confiables y precisas.,
la amniocentesis en serie se inicia a intervalos de 10-14 días para controlar la gravedad de la enfermedad en el feto. Todos los intentos deben hacerse para evitar el paso transplacentario de la aguja que puede conducir a la hemorragia fetomaternal (FMH) y un aumento adicional en el título del anticuerpo. Los valores seriados de delta – OD 450 se representan en la carta de Queenan o en la carta de Liley extendida para evaluar el riesgo de hidropesía fetal. La ecografía temprana se realiza para establecer la edad gestacional correcta., También se realiza una monitorización ecográfica frecuente para evaluar el bienestar fetal y detectar anemia moderada y signos tempranos de hidropesía.
La velocidad máxima de Doppler de la arteria cerebral media sistólica (ACM) ha demostrado ser una herramienta de detección confiable para detectar la anemia fetal y ha reemplazado a la amniocentesis. El MCA se visualiza fácilmente con el Doppler de flujo de color; el Doppler pulsado se utiliza para medir la velocidad sistólica pico justo distal a su bifurcación de la arteria carótida interna., Debido a que la velocidad del MCA aumenta con el avance de la edad gestacional, el resultado se informa en múltiplos de mediana (Mamás). En estudios recientes, se ha demostrado que la sensibilidad para la detección de anemia fetal moderada y severa es del 100%, con una tasa de falsos positivos del 10% a 1,5 MOM. Se ha demostrado que reduce la necesidad de procedimientos diagnósticos invasivos como la amniocentesis y la cordocentesis en más del 70%.
Los estudios Doppler de ACM pueden iniciarse a las 18 semanas de gestación, pero no son fiables después de las 35 semanas de gestación., También se ha utilizado para cronometrar la posterior transfusión fetal y para diagnosticar anemia de múltiples causas, como en la transfusión gemela-gemela. La pendiente de MCA de lecturas de 3 semanas ahora se usa para predecir el riesgo fetal de anemia severa (vea la imagen a continuación).
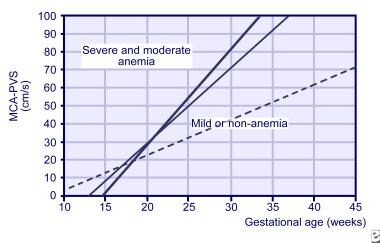 pendientes para la velocidad sistólica máxima en la arteria cerebral media (MCA) para fetos normales (línea punteada), fetos ligeramente anémicos (línea delgada) y fetos con anemia severa (línea gruesa).,
pendientes para la velocidad sistólica máxima en la arteria cerebral media (MCA) para fetos normales (línea punteada), fetos ligeramente anémicos (línea delgada) y fetos con anemia severa (línea gruesa)., con la adquisición de experiencia en la realización del estudio Doppler MCA, la amniocentesis seriada para la detección de anemia fetal se ha utilizado en menor medida.
durante el período en que la transfusión peritoneal intrauterina fue el único medio de tratamiento, los recién nacidos fueron entregados rutinariamente a las 32 semanas de gestación. Este enfoque resultó en una alta incidencia de enfermedad de la membrana hialina y transfusiones de intercambio., Con la llegada de la transfusión intravascular (IVT) en el útero, el enfoque general para el feto gravemente afectado es realizar IVT según sea necesario hasta 35 semanas de gestación, con el parto planeado a término. El establecimiento de la madurez pulmonar es difícil en estos fetos debido a la contaminación del líquido amniótico con sangre residual durante la transfusión; sin embargo, si el parto se planea antes de las 34 semanas de gestación, se indica la administración materna de esteroides para mejorar la madurez pulmonar fetal.,
Además, el exceso de bilirrubina en líquido amniótico causa una falsa elevación en la prueba de madurez pulmonar fetal TDx, Versión II (TDX-FLMII); por lo tanto, se deben usar otras pruebas para determinar la madurez pulmonar fetal, como la espectroscopia infrarroja, el recuento de cuerpos lamelares, la cuantificación de fosfatidilglicerol o la relación lecitina/esfingomielina (L/S).
Liley describió por primera vez la transfusión intraperitoneal (TPI) en 1963. Se introduce una aguja Tuohy en la cavidad peritoneal fetal bajo guía ecográfica., Se introduce un catéter epidural a través de la aguja. Se inyecta un medio radiopaco en el peritoneo fetal. La colocación apropiada se confirma por delineación fuera del intestino o debajo del diafragma o por difusión en ascitis fetal.,ss de 4 días de edad, grupo O, Rh negativo, kell negativo, leucorreducto, irradiado con 25 Gy para prevenir la enfermedad del injerto contra el huésped, y cruzado con suero materno se inyectan en alícuotas de 10 mL a un volumen calculado por la siguiente fórmula:
IPT volume = (gestación en semanas-20) × 10 mL
se estima que la hemoglobina residual (HB) en el feto permite el espaciamiento adecuado de la IPT y la selección de la gestación del parto mediante la siguiente fórmula:
HB g/dl = 0.,85/125 × A / b × 120-c/120
en la fórmula, a es la cantidad de HB de glóbulos rojos del donante transfundida, b es el peso corporal fetal estimado y c es el intervalo en días desde el momento de la transfusión hasta el momento de la estimación de HB del donante.
la TPI se repite cuando se estima que la Hb fetal ha descendido a 10 g / dL. Por lo general, se realiza una segunda TPI 10 días después de la primera transfusión con el fin de elevar la Hb por encima de 10 g/dL. Luego se realiza otra transfusión cada 4 semanas hasta el momento del parto planificado a las 34-35 semanas de gestación., Los movimientos diafragmáticos fetales son necesarios para que ocurra la absorción de glóbulos rojos. Este enfoque no tiene valor para un feto moribundo que no respira. Las complicaciones maternas incluyen infección y hemorragia transplacentaria, mientras que las complicaciones fetales son sobretransfusión, exanguinación, taponamiento cardíaco, infección, trabajo de parto prematuro y enfermedad de injerto contra huésped. Las tasas de supervivencia después de la TPI se acercaron aproximadamente al 75% con la ayuda de la ecografía.,
La TIV directa se ha convertido en una ruta preferida de intervención fetal debido a la mayor tasa de complicaciones y la efectividad limitada de la TPI en un feto hidropónico. Rodeck realizó por primera vez con éxito IVT en 1981. Con guía ecográfica, se introduce una aguja de calibre 20-22 en una vena umbilical en la inserción del cordón en la placenta o en su porción intrahepática, y se obtiene una muestra de sangre fetal. Se confirma que la muestra de sangre es de origen fetal mediante una prueba de desnaturalización alcalina rápida., Se realizan todas las pruebas fetales relevantes (por ejemplo, tipo de sangre, prueba directa de anticuerpos, recuento de reticulocitos, recuento de plaquetas, nivel de Hb, nivel de Hct, nivel de albúmina sérica, nivel de eritropoyetina). Si el nivel de Hb es inferior a 11 g/dL o si el nivel de Hct es inferior al 30%, se inicia una IVT. La posición de la aguja se confirma observando la turbulencia en el vaso fetal en la inyección de solución salina. El feto es frecuentemente paralizado con pancuronio y se le da fentanilo 10 mcg / kg para evitar el desplazamiento de la aguja por los movimientos fetales., La medicación materna varía de anestésico local solamente, a la indometacina rutinaria y sedación consciente, a la analgesia epidural espinal.
la transfusión se realiza en alícuotas de 10 mL a un volumen de aproximadamente 50 mL / kg de peso corporal estimado mediante ecografía o hasta alcanzar un nivel de TCH del 40%. El procedimiento se interrumpe inmediatamente si se observa descompensación cardíaca en los hallazgos de la ecografía., Los fetos gravemente anémicos no toleran la corrección aguda de su TCH a valores normales, y el TCH inicial no debe aumentarse más de 4 veces en el momento de la primera TIV. Luego deben ser monitoreados cada 2-7 días. La IVT se repite cuando alcanza un valor que refleja anemia crítica en el feto. Se puede anticipar una pérdida del 1% de células transfundidas por día.
algunos centros realizan transfusiones repetidas a intervalos de 10 días, 2 semanas y cada 3 semanas. Otros transfunden con base en una disminución anticipada de la hemoglobina fetal de 0,4 g / dL / día, 0,3 g/dL / día y 0.,2 g/dL / día para los intervalos de primera, segunda y tercera transfusión, respectivamente. La velocidad máxima sistólica del ACM ha sido utilizada para cronometrar la segunda transfusión, con un umbral de 1,32 M / M. Después de la primera transfusión intrauterina, la presencia de glóbulos rojos con hemoglobina adulta suprime la eritropoyesis y mejora el suministro de oxígeno, lo que es responsable de la mala correlación entre la velocidad máxima del ACM y la gravedad de la anemia fetal. Algunos centros han encontrado un efecto beneficioso de la transfusión combinada de TIV y TPI en el intervalo para repetir la transfusión.,
además de las complicaciones de la TPI, se han reportado bradicardia fetal transitoria, hematoma del cordón umbilical, compresión de la vena umbilical y muerte fetal durante la TIV. Sin embargo, la IVT tiene muchas ventajas, incluyendo la corrección inmediata de la anemia y la resolución de la hidropesía fetal, la tasa reducida de hemólisis y la hiperinsulinemia subsiguiente, y la aceleración del crecimiento fetal para fetos no hidrópicos que a menudo son retardados del crecimiento. La TIV es la única intervención disponible para fetos hidrópicos moribundos y aquellos con placenta anterior. El riesgo de pérdida fetal es de aproximadamente 0,8% con TIV versus 3.,5% por procedimiento para TPI, y la tasa de supervivencia general es de 88%.
Los glóbulos rojos maternos recientemente lavados se han utilizado con éxito como fuente de glóbulos rojos negativos para antígenos en el caso de incompatibilidad rara, pero también se han utilizado de forma rutinaria debido a beneficios como la disminución del riesgo de sensibilización a nuevos antígenos de glóbulos rojos, una vida media circulante más larga siendo fresca y un menor riesgo de transmisión de agentes virales. La madre puede donar una unidad de glóbulos rojos después del primer trimestre.,
en caso de inmadurez pulmonar y delta-OD 450 en la zona afectada de la curva de Queenan, la administración oral de 30 mg de fenobarbital a la madre 3 veces al día, seguida de inducción en una semana, reduce la necesidad de exanguinotransfusión en el neonato afectado. Excelentes algoritmos para el manejo del primer embarazo afectado y el embarazo en una madre con feto previamente afectado se describen en una revisión de Moise (ver las imágenes a continuación).
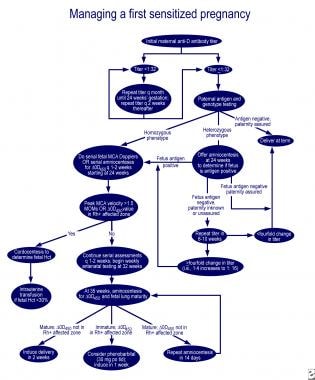 Administración de la primera gestación.,
Administración de la primera gestación., 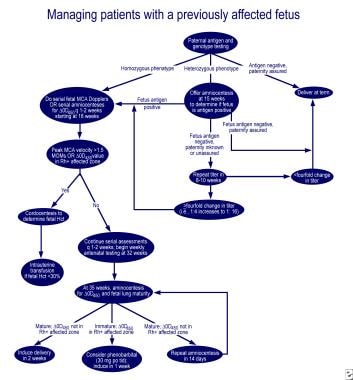 Gestión de las mujeres embarazadas con anterioridad feto afectado.
Gestión de las mujeres embarazadas con anterioridad feto afectado. los intentos iniciales de suprimir la producción de anticuerpos Rh con hapten Rh, estroma Rh positivo y administración de prometazina no tuvieron éxito. La plasmaféresis extensa con reemplazo parcial utilizando albúmina al 5% (intercambio plasmático terapéutico) e inmunoglobulina intravenosa (IGIV) o la administración de IGIV a 1 g/kg de peso corporal semanal ha demostrado ser moderadamente eficaz., El mecanismo de acción parece ser el bloqueo de los receptores Fc en la placenta, la reducción del transporte de anticuerpos a través del feto, los receptores Fc en los fagocitos en el sistema reticuloendotelial fetal, y la inhibición de retroalimentación de la síntesis de anticuerpos maternos. Sin embargo, se han observado citotoxicidad mediada por células dependientes de anticuerpos y elevación de rebote de la concentración de anticuerpos, alteración del flujo sanguíneo placentario durante el procedimiento y hemorragia posparto después del intercambio plasmático.,
en un estudio retrospectivo más reciente que incluyó a 5 mujeres embarazadas con HDFN grave debido a aloinmunización de glóbulos rojos, se informó de un tratamiento exitoso con un régimen combinado de intercambio plasmático terapéutico, IgIV y Transfusión intrauterina (IUT) al comienzo de los embarazos. Las mujeres se sometieron a 3 Procedimientos de intercambio plasmático durante las semanas 10-13 del embarazo, después de infusiones semanales de IGIV; los fetos recibieron unidades de glóbulos rojos que coincidían completamente con el fenotipo materno para los grupos de antígenos D, C, E, K, Fy, Jk y S. Todas las mujeres dieron a luz bebés sanos a las 33-38 semanas de gestación.,
sin embargo, estas técnicas solo posponen la necesidad de muestreo percutáneo de sangre umbilical (PUBS) e IVT hasta las 20-22 semanas de gestación, cuando estos procedimientos pueden realizarse con un riesgo más aceptable. Una revisión del uso de IGIV muestra su utilidad en la prevención de la aparición de hidropesía fetal y en el retraso de la necesidad de IUT., Por lo tanto, se ha sugerido un abordaje combinado de plasmaféresis que comienza a las 12 semanas de gestación 3 veces en esa semana, seguido de IGIV a una dosis de carga de 2 g/kg después de la tercera plasmaféresis, y luego continúa IGIV 1 g/kg/semana hasta las 20 semanas de gestación para fetos en riesgo antes de las 20 semanas de gestación y también se puede usar más tarde en la gestación si no se puede realizar la tiv o si la hidropesía no responde a la TIV.,
un reporte indicó que el tratamiento de fetos con aloinmunización severa usando IVT combinada con terapia de IVIG fetal a 1 g / kg / dosis a partir del tercer IVT ayudó a reducir la frecuencia de IVT y mejorar los signos de hidropesía. Un reporte de caso muestra un tratamiento exitoso de anemia severa e hidropesía en un feto con aloinmunización debido al anticuerpo anti-M con inyecciones intraperitoneales fetales de IGIV 2 g/kg administradas semanalmente a partir de las 30 semanas. Sin embargo, este fue un informe de caso, y se necesita un ensayo controlado aleatorio antes de que esto pueda convertirse en el estándar de atención.,
se usan regímenes similares de pruebas y tratamiento en el manejo de embarazos afectados por aloinmunización sin RHD, como anti-Rhc, anti-K (K1) y anti-M. Una vez que se diagnostica a la madre un anticuerpo asociado con enfermedad hemolítica, se realiza un título Coombs indirecto, junto con pruebas paternas para antígeno comprometido y cigosidad. Los títulos maternos se repiten (mensualmente hasta las 28 semanas de gestación y luego cada 2 semanas) hasta alcanzar un umbral de anemia fetal (1:8 para Kell y 1:32 para reposo).,
la tipificación del antígeno Fetal se realiza mediante amniocentesis o ADN fetal libre de células en plasma materno si el padre es heterocigoto (100% para K1, 65% para M). Cuando se sabe que el feto es antígeno positivo, se realiza vigilancia para la anemia fetal severa, con detección Doppler de MCA semanal a partir de las 16-18 semanas y IUT se lleva a cabo si supera 1,5 mamá con un parto a las 38 semanas de gestación.
se ha demostrado que los aloanticuerpos maternos a los leucocitos paternos producen bloqueo Fc y reducen la gravedad de la anemia hemolítica fetal., Esto puede ser utilizado en el futuro.
El Manejo del neonato sensibilizado
la enfermedad hemolítica leve representa el 50% de los recién nacidos con resultados positivos en la prueba de anticuerpos directos. La mayoría de estos recién nacidos no son anémicos (hemoglobina del cordón umbilical >14 g/dL) y tienen hemólisis mínima (bilirrubina del cordón umbilical < 4 mg/dL). Aparte de la fototerapia temprana, no requieren transfusiones. Sin embargo, estos recién nacidos están en riesgo de desarrollar anemia severa tardía a las 3-6 semanas de vida. Por lo tanto, es importante monitorear sus niveles de Hb después del alta hospitalaria.,
la enfermedad hemolítica moderada representa aproximadamente el 25% de los neonatos afectados. La enfermedad hemolítica moderada del recién nacido se caracteriza por anemia moderada y aumento de los niveles de bilirrubina del cordón umbilical. Estos bebés no presentan ictericia clínica al nacer, pero desarrollan rápidamente hiperbilirrubinemia no conjugada en las primeras 24 horas de vida. El frotis periférico muestra numerosos glóbulos rojos nucleados, disminución de plaquetas y, ocasionalmente, un gran número de granulocitos inmaduros., Estos recién nacidos a menudo tienen hepatoesplenomegalia y están en riesgo de desarrollar encefalopatía de bilirrubina sin el tratamiento adecuado. Generalmente se requiere una transfusión de intercambio precoz con glóbulos rojos frescos Rh-negativos tipo o con fototerapia intensiva. El uso de IGIV en dosis de 0,5-1 g/kg en un régimen de dosis única o múltiple ha podido reducir eficazmente la necesidad de exanguinotransfusión.,
un estudio prospectivo aleatorizado controlado ha demostrado que la IGIV temprana en dosis altas de 1 g / kg a las 12 horas de edad reduce la duración de la fototerapia y la estancia hospitalaria y previene la exanguinotransfusión en neonatos con isoinmunización Rh de moderada a grave. Estos recién nacidos también están en riesgo de desarrollar anemia hiporegenerativa tardía de la infancia a las 4-6 semanas de vida. Sin embargo, un ensayo aleatorizado doble ciego controlado con placebo no mostró el beneficio de la terapia profiláctica con IGIV 0.,75 g / kg dentro de las 4 horas de edad en neonatos gravemente afectados que fueron tratados con transfusión intrauterina para isoinmunización Rh.
la enfermedad hemolítica grave representa el 25% restante de los recién nacidos aloinmunizados que nacen muertos o hidropónicos al nacer. La hidropesía fetal es causada predominantemente por un síndrome de fuga capilar debido a hipoxia tisular, hipoalbuminemia secundaria a disfunción hepática e insuficiencia cardíaca de alto rendimiento por anemia., Aproximadamente la mitad de estos fetos se vuelven hidrópicos antes de las 34 semanas de gestación y necesitan un monitoreo y manejo intensivo de la gestación aloinmunizada como se describió anteriormente. Las hidropesía leve que involucran ascitis se revierten con IVTs en solo 88% de los casos con mejor supervivencia, pero las hidropesía severa que causan edema del cuero cabelludo y ascitis severa y derrames pleurales se revierten en 39% de los casos y se asocian con una supervivencia deficiente.
manejo de la incompatibilidad ABO
El manejo de la hiperbilirrubinemia es una preocupación importante en recién nacidos con incompatibilidad ABO., Los criterios para la exanguinotransfusión y la fototerapia son similares a los utilizados en la aloinmunización Rh. La IGIV también ha sido muy eficaz cuando se administra al principio del curso. Tin (Sn) porfirina se ha demostrado que un potente inhibidor de la hemo oxigenasa, la enzima que cataliza el paso limitante de la velocidad en la producción de bilirrubina a partir del hemo, reduce la producción de bilirrubina y reduce la necesidad de transfusión de intercambio y la duración de la fototerapia en neonatos con incompatibilidad ABO.
se han estudiado protoporfirina o mesoporfirinas de estaño o zinc en recién nacidos., Deben administrarse por vía intramuscular en una dosis basada en el peso corporal, y su eficacia parece estar relacionada con la dosis en todas las gestaciones. Sus posibles efectos tóxicos incluyen fotosensibilización de la piel, deficiencia de hierro y posible inhibición de la producción de monóxido de carbono. No se ha notificado su uso en la enfermedad hemolítica Rh del recién nacido. Todavía no se puede recomendar su uso rutinario debido a la falta de datos de seguridad a largo plazo.
















Deja una respuesta