| La Universidad de Sheffield | |
| Departamento de Química | VSEPR |
tiene cuatro pares de electrones y la geometría de coordinación del nitrógeno se basa en una disposición tetraédrica de pares de electrones. Solo hay tres grupos unidos, por lo tanto hay un par solitario. Sin embargo, dado que los pares solitarios son «invisibles», la forma del amoníaco es piramidal.,r>
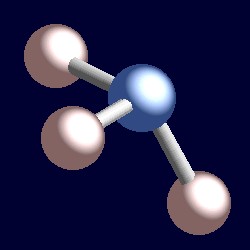
considere un par de electrones enlazantes. Los dos electrones están situados entre dos núcleos, y son atraídos por ambos. Una pareja solitaria es diferente. Necesariamente solo es atraído a un núcleo y la consecuencia es que adopta una posición efectivamente más cercana a ese núcleo que a los pares de electrones enlazantes. Esto significa que el ángulo sólido efectivo ocupado por un par solitario es mayor que el ocupado por un par de enlace., Los pares solitarios demandan mayor espacio angular, y están ubicados más cerca de sus átomos que los pares de enlaces. La consecuencia de esto para el amoníaco es que el par solitario hace espacio para sí mismo empujando los tres átomos de hidrógeno juntos un poco y los ángulos de enlace H-N-H son ligeramente menores (106.6°) que el ángulo tetraédrico ideal de 109.5°.
















Deja una respuesta